Flussyre. Egenskaper og bruksområder for flussyre
flussyre, flussyre i odontologi
Flussyre(fluorsyre, flussyre, flussyre) - en vandig løsning av hydrogenfluorid (HF). Industrien produserer i form av 40 % (oftere), samt 50 % og 72 % løsninger. Navnet "fluorsyre" kommer fra flusspat, hvorfra man får hydrogenfluorid.
- 1 Egenskaper
- 1.1 Fysisk
- 1.2 Kjemisk
- 2 Teknisk flussyre
- 3 Søknad
- 4 Giftige egenskaper
- 5 Merknader
Egenskaper
Fysisk
Fargeløs væske. Oppløsningen av hydrogenfluorid i vann er ledsaget av en ganske betydelig frigjøring av varme (59,1 kJ/mol). Den er karakterisert ved dannelsen av en azeotrop blanding som inneholder 38,3 % HF og koker ved 112 °C (ifølge andre kilder, 37,5 % og tbp 109 °C). Denne azeotrope blandingen oppnås til slutt ved destillasjon av både konsentrert og fortynnet syre.
Ved lave temperaturer danner hydrogenfluorid ustabile forbindelser med vann av sammensetningen H2O HF, H2O 2HF og H2O 4HF. Den mest stabile av dem er den første (smelte −35 °C), som bør betraktes som hydroniumfluorid - F. Den andre er hydroniumhydrofluorid.
Kjemisk
Flussyre er en syre med middels styrke (dissosiasjonskonstanten er 6,8 10−4, graden av dissosiasjon av en 0,1 N løsning er 9%). Det korroderer glass og andre silikatmaterialer, så flussyre lagres og transporteres i polyetylenbeholdere.
Reaksjonen fortsetter med frigjøring av gassformig silisiumfluorid (SiF4):
Det reagerer med mange metaller for å danne fluorider (bly løses ikke opp i flussyre, siden det dannes uløselig fluor PbF2 på overflaten; platina, palladium og gull løses heller ikke opp), påvirker ikke parafin, som brukes ved lagring av denne syren.
Teknisk flussyre
Teknisk flussyre inneholder vanligvis en rekke urenheter - Fe, Rb, As, fluorkiselsyre H2SiF6, SO2, etc.
For grovrengjøring destilleres den i apparater laget av platina eller bly, og kaster de første delene av destillatet.
For å få en renere syre omdannes teknisk syre til kaliumhydrofluorid, deretter spaltes den ved oppvarming, oppløsning av hydrogenfluorid i destillert vann.
Sterk flussyre (mer enn 60 % HF) kan lagres og transporteres i ståltanker. For lagring og håndtering av flussyre i laboratorieforhold de mest praktiske karene er laget av teflon, polyetylen og annen plast.
applikasjon
En stor forbruker av flussyre er aluminiumsindustrien.
- En løsning av hydrogenfluorid brukes til gjennomsiktig etsing av silikatglass (for eksempel inskripsjoner - for dette er glasset belagt med parafin, skjærehull for etsing). Mattetsing oppnås i hydrogenfluoriddamp.
- For silisiumetsing i halvlederindustrien.
- Som en del av beising, beising og poleringsblandinger, løsninger for elektrokjemisk bearbeiding av rustfritt stål og spesiallegeringer.
- Produksjon av fluorider, silisiumfluorider og borfluorider, organofluorforbindelser, samt tilsvarende syrer (hydrosilicic acid og hydroboric acid), syntetiske smøreoljer og plast.
- For oppløsning av silikater i ulike typer analyser.
- I alkyleringsprosessen, som en katalysator i reaksjonen av isobutan og olefin.
Giftige egenskaper
Flussyre er giftig. Det har en svak narkotisk effekt. Mulig akutt og kronisk forgiftning med endringer i blodet og hematopoietiske organer, organer i fordøyelsessystemet, lungeødem.
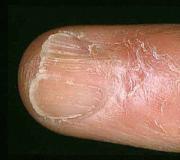
Det har en uttalt effekt ved innånding, irriterende på huden og slimhinnene i øynene (forårsaker smertefulle brannskader og sårdannelse); hudresorptiv, embryotropisk, mutagen og kumulativ virkning. Hun ble tildelt den andre fareklassen for miljø, mens rent hydrogenfluorid tilhører den første fareklassen.
Når det kommer i kontakt med huden i første øyeblikk, forårsaker det ikke sterke smerter, det absorberes lett og umerkelig, men gjennom en kort tid forårsaker hevelse, smerte, kjemiske brannskader og generelle toksiske effekter. Symptomer fra eksponering for svakt konsentrerte løsninger kan vises en dag eller enda mer etter kontakt med huden.
Når det kommer inn i blodet gjennom huden, binder det blodkalsium og kan forårsake brudd på hjerteaktiviteten. Brannskader med et areal på mer enn 160 cm2 er farlige på grunn av mulige systemiske giftige manifestasjoner.
Toksisiteten til flussyre og dens løselige salter skyldes antagelig evnen til frie fluoridioner til å binde biologisk viktige kalsium- og magnesiumioner til uløselige salter (se Fluorforgiftning). Derfor, for å behandle effekten av eksponering for flussyre, brukes kalsiumglukonat ofte som en kilde til Ca2+-ioner. Berørte områder med flussyreforbrenninger vaskes med vann og behandles med 2,5 % kalsiumglukonatgel. Men siden syren trenger inn i huden, er bare skylling ikke nok, og en legetime er nødvendig for behandling. Høy effektivitet ble vist ved intraarterielle infusjoner av kalsiumklorid.
Maksimal tillatt konsentrasjon (MAC) av flussyre:
Notater
- Den originale uttalevarianten "Plavikovaya", registrert i ordbøkene fra 1800-tallet (for eksempel i ordboken til V. I. Dahl) og første halvdel av 1900-tallet, er utdatert.
- Oppløsning av glass i flussyre - videoopplevelse i United Collection of Digital Educational Resources
- GOST 12.1.007-76: System for arbeidssikkerhetsstandarder. Skadelige stoffer
- el Saadi MS, Hall AH, Hall PK, Riggs BS, Augenstein WL, Rumack BH (1989). "Hydrofluoric acid dermal eksponering". Vet Hum Toxicol 31 (3): 243–7. PMID 2741315.
- Roblin I, Urban M, Flicoteau D, Martin C, Pradeau D (2006). "Topisk behandling av eksperimentelle flussyreforbrenninger med 2,5 % kalsiumglukonat". J Burn Care Res 27 (6): 889–94. DOI:10.1097/01.BCR.0000245767.54278.09. PMID 17091088.
- Anbefalt medisinsk behandling for eksponering av flussyre (PDF). Honeywell spesialmaterialer. Hentet 6. mai 2009. Arkivert fra originalen 2. februar 2012.
- Intraarteriell kalsiuminfusjon for flussyreforbrenninger. NCBI. Hentet 3. januar 2010.
flussyre, flussyre i tannlegen, kjøp flussyre, flussyre formel
Flussyreinformasjon om
Uvanlig blant syrer
De sovjetiske Ural er rike. I innvollene i fjellene er det mange forskjellige mineraler. På høyre bredd av elven Miass, som renner gjennom Zlatoust-distriktet i Ural-regionen, strekker de lave Ilmensky-fjellene seg. Naturen har skapt et slags spiskammer av sjeldne mineraler i Ilmensky-fjellene: topas, ilmenitt og andre. Som blomster om våren, glitrer flerfargede krystaller av flusspat i solen - et mineral som har de mest forskjellige farger. I krystallene er hele spekteret av farger representert - fra rødt til lilla. Men flusspat er bemerkelsesverdig ikke bare for rikdommen i fargen. Fra det, ved behandling med konsentrert svovelsyre, oppnås et bemerkelsesverdig stoff - hydrogenfluorid, en vandig løsning som kalles flussyre.
Flussyre har egenskaper som andre syrer ikke har. Alle syrer er vanligvis lagret i glassbeholder. Men det er verdt å få bare en liten dråpe flussyre på veggen glassvarer hvordan et dypt skall umiddelbart dannes på den, og med en mer eller mindre langvarig eksponering, et hull.
Flussyre korroderer lett glass, så det lagres vanligvis i ebonitt-, bly- eller parafinbelagte glasskar.
Egenskapen til flussyre til å korrodere glass brukes i bearbeiding av glassprodukter. De fineste mønstrene og et bredt utvalg av tegninger brukes "på glass ved bruk av hydrogenfluorid eller dets vandig løsning- flussyre. For å gjøre dette er overflaten av glasset dekket med et tynt lag parafin, hvorpå ønsket inskripsjon eller tegning er laget med en skarp gjenstand, hvoretter overflaten fuktes med flussyre eller plasseres i en strøm av gassformig hydrogenfluorid. . Når glass behandles med flussyre er mønsteret gjennomsiktig, og ved bruk av gassformig hydrogenfluorid er det matt.
Flussyre brukes i glasspolering for å fjerne uregelmessigheter på overflaten av glassprodukter. Glassoverflaten males grundig og legges deretter i en løsning bestående av en blanding av svovelsyre og flussyre.
Vannfritt hydrogenfluorid er en væske med et kokepunkt på +19,5 ° C og et frysepunkt på -92 ° C. Det er et veldig sterkt tørkemiddel. Det er ingen kjemiske forbindelser som ikke kan drikkes ved hjelp av hydrogenfluorid, og vann kan ikke skilles fra flussyre kun ved elektrolyse.
Vannfritt hydrogenfluorid er en sterk syre. Imidlertid kan dens vandige løsning - flussyre - ikke klassifiseres som sterke syrer - dette er en egenskap som ikke finnes i noen av de andre syrene.
En svært verdifull egenskap ved hydrogenfluorid, på grunn av hvilken det har funnet bred anvendelse i industrien, er dets uttalte katalytiske - akselererende - effekt på mange kjemiske reaksjoner. Av prosessene katalysert av hydrogenfluorid er den viktigste den kjemiske prosessen med å behandle hydrokarboner i produksjonen av motordrivstoff.
Uvanlige egenskaper av flussyre gir kjemisk element fluor inkludert i sammensetningen Den oksiderende kraften til fluor er mye høyere enn oksygen. Brennbare materialer - tre, gummi og andre - når de introduseres i fluoratmosfæren, blusser de umiddelbart opp og brenner ut. Fluor interagerer med nesten alle metaller ved vanlige temperaturer; de eneste unntakene er gull og platina. Men når oppvarmet, og eni reagerer med det. Fluor oksiderer jevnt oksygen. Av alle grunnstoffene som finnes på jorden, er fluor
Ingeniør A. SEREGIN Fig. I. SMOLYANINOVA
Strukturen til fluoratomet
I39Ch8 O S N O V V
gir størst evne til å gå inn i kjemiske reaksjoner. Derfor ble navnet gitt til ham fra det greske ordet "fluoros", som på gresk betyr "ødelegge".
I ren form Fluor ble oppnådd i 1886 av den franske kjemikeren Moissan i elektrolyse av flussyre.
Fluor er en gulgrønn gass, den blir til en væske ved en temperatur på -187,9 ° C, og i fast-■ ved en temperatur på -223°C. Gassformig fluor er 1,31 ganger tyngre enn luft.
Den praktiske verdien av dette eller det stoffet bestemmes i stor grad av dets utbredelse og tilgjengelighet. Fluor er ikke et sjeldent grunnstoff på jorden. I jordskorpen som ulike salter fluor inneholder ca. 0,078®/". Det er omtrent det samme. hvor mange grunnstoffer som nitrogen, karbon, mangan, krom og fosfor er. Når det gjelder prevalens, rangerer fluor på trettende plass blant andre elementer.
Av fluorforbindelsene som finnes i jordskorpen, er det viktigste mineralet som allerede er kjent for oss - flusspat - fluoritt.
Fluor finnes i planter og dyr. Blader av planter inneholder fra 3 til 14 mg fluor per 1 g tørrvekt. I menneskelige tenner og hår varierer fluorinnholdet fra 100 til 180 mg per 100 g.
Betydelige mengder fluor inneholder naturlig vann. Sjøvann har, i form av vannløselige fluorsalter, ca 0,3 mg fluor per liter. Derfor kan 0,3 g rent fluor fås fra ett tonn sjøvann.
Fluorforbindelser er for tiden mye brukt både i vitenskapelige laboratorier og i industribedrifter.
FLUORFORBINDELSER - BYGGEMATERIALE
Organiske stoffer spiller en stor rolle i menneskers liv. De brukes som drivstoff og mat (olje, torv, kull, frukt og korn fra planter, animalsk fett, etc.) og som byggemateriale (tre, stoffer, gummi, kunstige plastmaterialer og andre). Og hvis organiske forbindelsers høye evne til å inngå kjemiske reaksjoner, spesielt deres lette oksiderbarhet, er fordelaktig når de brukes som næringsstoffer og brensel, vil slike egenskaper for byggemateriale uønsket på grunn av oksidasjon håndverk i tre kollapse, forringes, stoffer blekner osv.
Men så snart hydrokarboner erstatter hydrogenatomene som utgjør molekylene deres med fluoratomer, får de resulterende forbindelsene - fluorkarboner, mens de forblir relatert til organiske forbindelser, egenskaper som ikke er karakteristiske for disse forbindelsene. Fluorkarboner, så vel som mineralske fluorforbindelser, er helt upåvirket av oksidasjon. Oyi kan ikke tjene som mat for insekter og bakterier, som et resultat av at gjenstander laget av fluorholdige forbindelser eller impregnert med dem er utilgjengelige for forråtnelse og skadelige effekter av insekter, noe som er spesielt viktig for byggematerialer.
Natriumklorid er mye brukt til å impregnere tre. Det beskytter treverket mot soppangrep. Natriumfluoridløsning er impregnert med jernbanesviller, telegrafstolper og annet byggevarer. Levetiden til tre behandlet med natriumfluorid øker flere ganger.
Fluorokarboner er nær edelgasser når det gjelder kjemisk inerthet. Denne motstanden gjør at de kan brukes som materiale for kjemisk utstyr.
Det er kjent at mineraloljer som brukes til å smøre ulike mekanismer mister sine smøreegenskaper ved forhøyede temperaturer, som et resultat av
— uorganisk materiale, monobasisk syre, HF-løsning i vann. Reagenset kalles også flussyre og flussyre. Sistnevnte navn skyldes det faktum at hydrogenfluorid er hentet fra flusspat som inneholder fluor (CaF2), et meget vakkert fluorittmineral som lyser under ultrafiolett stråling eller ved oppvarming.
Egenskaper
Forbindelsen er en klar væske, fargeløs, med en skarp lukt. Den brenner ikke, men er svært giftig for mennesker og miljø. Fra et kjemisk synspunkt er det en syre med middels styrke. Det reagerer med de fleste metaller, og danner salter - fluorider. Alkalimetallsalter er vannløselige, mens jordalkalimetallsalter er dårlig løselige eller fullstendig uløselige. Reagens uansett konsentrasjon løser ikke opp bly, platina, palladium, gull, reagerer ikke med parafin, polyetylen, fluoroplast og annen plast, gummimaterialer. En syre som inneholder mer enn 60 % HF interagerer ikke med jern.
En viktig egenskap ved flussyre er at den er den eneste som reagerer med silisiumoksid, som danner grunnlaget for alle silikatmaterialer, inkludert glass. Derfor kan det ikke helles i glasskar.
Flussyre har en annen interessant eiendom- vann med tilsetning av selv en liten mengde av dette reagenset fryser ved lavere temperaturer.
Sikkerhetstiltak
Flussyre og dens damper er giftige. Fortynnet syre er spesielt lumsk: hvis det spruter på huden, kan en person ikke føle noe i det hele tatt, men stoffet vil bli absorbert i huden og gå inn i blodet. Etter omtrent en dag vil symptomer på giftig forgiftning, lungeødem og forstyrrelse av det kardiovaskulære systemet og mage-tarmkanalen vises, siden forbindelsen danner uløselige kalsium- og magnesiumsalter, og binder disse elementene som er viktige for normal funksjon av kroppen. En kjemisk forbrenning vil vises på huden på grunn av at reagenset ødelegger fiber.
Flussyre irriterer luftveiene, øynene, har en liten narkotisk effekt, har evnen til å skade DNA og forsterke effekten av andre ugunstige faktorer. Det tilhører den andre fareklassen (gassformig hydrogenfluorid - til den første). Det er nødvendig å arbeide med flussyre kun i åndedrettsvern, i vernebriller som sitter tett mot huden, i verneklær og gummihansker, i avtrekkshette. Ved eliminering av søl anbefales det å bruke gassmasker med en autonom luftkilde. Ofre for forgiftning bør umiddelbart bringes til sykehuset etter å ha vasket kontaktstedet med reagenset stort beløp vann og gelering med 2,5 % kalsiumglukonat. På sykehuset brukes vanligvis en intraarteriell infusjon av kalsiumklorid som motgift.
Lagring og transport
Flussyre lagres og transporteres i plastbeholdere (polyetylen, fluorplast), beholdere og kuber. For store beholdere brukes en metallkasse. Syre med høy konsentrasjon tillates transportert med jernbane og med bil i jern- og ståltanker. Temperaturregime- ikke høyere enn +30 °С.
applikasjon
Flussyre produseres i ulike konsentrasjoner, høy renhet og teknisk med urenheter. De viktigste bruksområdene:
— I petrokjemi- og gruveindustrien — for å øke oljeproduksjonen og ødelegge silisiumholdige bergarter.
- For utvinning av visse metaller, for eksempel tantal, zirkonium, niob.
- I kjemisk industri - som katalysator i enkelte prosesser; for produksjon av fluorplast, kjølemidler, fluorholdige syrer, borater og fluorider, organiske forbindelser basert på fluor, syntetiske smøreoljer.
- I glassbransjen ved hjelp av denne kjemikalien. reagens utføre gjennomsiktig etsing av silisiumglass.
Flussyre med høy renhet er avgjørende for rengjøring og etsing av silisium for halvledere.
- I analytisk kjemi - for oppløsning av silikater.
– I produksjon av aluminium og arbeid med det.
- Er en integrert del væsker brukt til beising og polering, for elektrokjemisk bearbeiding av legeringer og rustfritt stål. Den brukes også til å rense metallemner fra sand.
Flussyre
Flussyre
Beskrivelse
Flussyre eller flussyre- en fargeløs væske, som er en løsning av gassformig hydrogenfluorid i vann. En liten mengde flussyre senker vannets frysepunkt betydelig.
Flussyreødelegger glass, interagerer med silisiumdioksid, som er en del av glasset, med dannelse av gassformig silisiumtetrafluorid. Flussyre løser opp noen metaller for å danne fluorider. Kalsium-, barium- og strontiumfluorider er praktisk talt uløselige i vann. Fluoridene av kobber, nikkel, kadmium og krom (III) er lite løselige, alle andre fluorider, inkludert sølvfluorid, er lett løselige.
Flussyre løser opp sink og jern, svært sakte bly, kobber og sølv, reagerer ikke med gull og platina.
applikasjon
- for ødeleggelse av silikatbergarter;
- oppløsning av metaller (tantal, zirkonium, niob, etc.);
- hydrogeneringskatalysator;
- dehydrogeneringskatalysator;
- alkyleringskatalysator i organisk kjemi;
- reagens i produksjon av freoner og fluorplaster;
- utgangsmateriale for å oppnå fluor;
- produksjon av fluorsulfonsyre;
- funnet i produksjonen av superfosfater, aluminium, uran, beryllium og mangan; smeltende flukser; ved sveising med elektroder, hvis belegg inkluderer fluorforbindelser, eller ved nedsenket lysbuesveising.
Oppbevaring
butikk flussyre i parafin-, vinylklorid-, platina-, fluorplast- og polyetylenkar, samt i organiske glasskar.
Fluoroplastskåler er veldig gode til å jobbe med syre. flussyre kan helles i glass forhåndsbelagt med et lag parafin. Retter laget av voks, parafin, ceresin og guttaperka er lite pålitelige.
I store volumer flussyre lagret i stålforseglede tanker og tanker, samt i ammoniakk-type sylindere med en beskyttende farge med en rød stripe.
Forebyggende tiltak
Flussyre er giftig, irriterer luftveiene, er det sterkeste vannfjernende stoffet, kommer på huden, forårsaker alvorlige brannskader og sår.
Å jobbe med flussyre det er nødvendig under godt trekk, ved bruk av platinavarer, er det ønskelig i gummihansker.
Flussyre kan forårsake etsende effekt på huden ikke umiddelbart, men etter noen timer. Røyken som genereres i nærvær av ammoniakk er også giftig. For brannskader flussyre umiddelbart vaskes huden med rennende vann i flere timer til den bleke overflaten av huden blir rød. Deretter påføres en nylaget 20 % suspensjon av magnesiumoksid i glyserin.
Flussyre er brannfarlig. Vann kan brukes til å slukke.
I nærvær av hydrogenfluorid i luften, er det nødvendig å bruke en isolerende gassmaske (oksygenmaske).
For å kjøpe dette produktet, samt for å få en prisliste, vennligst kontakt lederne av selskapet vårt.
Alle vannløselige fluorider er giftige.
| Generell | |
|---|---|
| Systematisk Navn |
hydrogenfluorid |
| Tradisjonelle navn | flussyre |
| Chem. formel | HF |
| Fysiske egenskaper | |
| Stat | fargeløs væske |
| Molar masse | 20,0063 g/mol |
| Tetthet | 1,258 (70 %) |
| Termiske egenskaper | |
| T. smelte. | −75 (70 %) |
| T. kip. | 85,8 (70 %) °C |
| T. rev. | ikke brennbar °C |
| Kjemiske egenskaper | |
| pK a | 3,17 |
| Løselighet i vann | blandet |
| Klassifisering | |
| Reg. CAS-nummer | 7664-39-3 |
| Reg. EC-nummer | 231-634-8 |
| RTECS | MW7875000 |
| Sikkerhet | |
| Giftighet | |
| Data er basert på standardforhold (25 °C, 100 kPa) med mindre annet er angitt. | |
Egenskaper
Fysisk
En fargeløs, mobil væske med en skarp lukt og en brennende "eddikaktig" smak. Oppløsningen av hydrogenfluorid i vann er ledsaget av en ganske betydelig frigjøring av varme (59,1 kJ/mol). Den er karakterisert ved dannelsen av en azeotrop blanding som inneholder 38,6 % HF og koker ved 114 °C (ifølge andre kilder, 37,5 % og kokepunkt t 109 °C). Denne azeotrope blandingen oppnås til slutt ved destillasjon av både konsentrert og fortynnet syre.
Ved lave temperaturer danner hydrogenfluorid ustabile forbindelser med vann av sammensetningen H 2 O HF, H 2 O 2HF og H 2 O 4HF. Den mest stabile av dem er den første (t pl −35 °C), som bør betraktes som hydroniumfluorid - [Н 3 O]F. Den andre er hydroniumhydrofluorid [H 3 O].
Kjemisk
Flussyre er en ganske svak syre (med middels styrke) (dissosiasjonskonstanten er 6,8⋅10 −4, dissosiasjonsgraden til en 0,1 N løsning er 9%), men den korroderer glass og andre silikatmaterialer, så flussyre lagres og transporteres i polyetylenbeholder.
Reaksjonen fortsetter med frigjøring av gassformig silisiumfluorid (SiF 4):
N a 2 O ⋅ C a O ⋅ 6 S i O 2 + 28 HF → N a 2 S i F 6 + C a S i F 6 + 4 S i F 4 + 14 H 2 O (\displaystyle (\mathsf ( Na_(2)O\cdot CaO\cdot 6SiO_(2)+28HF\høyrepil Na_(2)SiF_(6)+CaSiF_(6)+4SiF_(4)\uparrow +14H_(2)O))).
Reagerer med mange metaller og danner fluorider (bly løses ikke opp i flussyre, siden det dannes uløselig fluor PbF 2 på overflaten; platina, palladium og gull løses heller ikke opp), påvirker ikke parafin, som brukes ved lagring av denne syren.
Teknisk flussyre
Teknisk flussyre inneholder vanligvis en rekke urenheter - Fe, Rb, As, hydrofluorkiselsyre H 2 SiF 6, SO 2, etc.
For grovrengjøring destilleres den i apparater laget av platina eller bly, og kaster de første delene av destillatet.
For å få en renere syre omdannes teknisk syre til kaliumhydrofluorid, deretter spaltes den ved oppvarming, oppløsning av hydrogenfluorid i destillert vann.
Sterk flussyre (over 60 % HF) kan lagres og transporteres i stålcontainere, men korroderer glass. Lagring og håndtering av flussyre i laboratoriet krever kar laget av teflon, polyetylen og annen plast.
applikasjon
En stor forbruker av flussyre er aluminiumsindustrien.
- En løsning av hydrogenfluorid brukes til gjennomsiktig etsing av silikatglass (for eksempel inskripsjoner - for dette er glasset belagt med parafin, skjærehull for etsing). Mattetsing oppnås i hydrogenfluoriddamp.
- For silisiumetsing i halvlederindustrien.
- Som en del av beising, beising og poleringsblandinger, løsninger for elektrokjemisk bearbeiding av rustfritt stål og spesiallegeringer.
- Innhenting av fluorider, silikofluorider og borfluorider, organofluorforbindelser, samt tilsvarende syrer (hydrokiselsyre og hydroboric acid), syntetiske smøreoljer og plast.
- For oppløsning av silikater i ulike typer analyser.
- I alkyleringsprosessen, som en katalysator i reaksjonen av isobutan og olefin.
Giftige egenskaper
giftig. Mulig akutt og kronisk forgiftning med endringer i blodet og hematopoietiske organer, organer i fordøyelsessystemet, lungeødem.
Det har en uttalt effekt ved innånding, irriterende på huden og slimhinnene i øynene (forårsaker smertefulle brannskader og sårdannelse); hudresorptiv, embryotropisk, mutagen og kumulativ virkning. Hun ble tildelt den andre klassen av miljøfare; rent hydrogenfluorid tilhører også den andre fareklassen.
Når det kommer i kontakt med huden, forårsaker det i første øyeblikk ikke sterke smerter, det absorberes lett og umerkelig, men etter kort tid forårsaker det hevelse, smerte, kjemiske brannskader og generelle toksiske effekter. Symptomer fra eksponering for svakt konsentrerte løsninger kan vises en dag eller enda mer etter kontakt med huden.
Når det kommer inn i blodet gjennom huden, binder det blodkalsium og kan forårsake brudd på hjerteaktiviteten. Brannskader med et areal på mer enn 160 cm 2 er farlige med mulige systemiske toksiske manifestasjoner.
Toksisiteten til flussyre og dens løselige salter skyldes antagelig evnen til frie fluorioner til å binde biologisk viktige kalsium- og magnesiumioner til uløselige salter ( fluorforgiftning). Derfor, for å behandle effekten av eksponering for flussyre, brukes det ofte