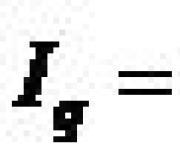Formiranje vodonika. Različiti oblici vodonika
Najčešći hemijski element u svemiru je vodonik. Ovo je neka vrsta referentne tačke, jer je u periodnom sistemu njen atomski broj jednak jedan. Čovječanstvo se nada da će moći saznati više o njemu kao jednom od najmogućijih Vozilo u budućnosti. Vodonik je najjednostavniji, najlakši, najčešći element, ima ga posvuda - sedamdeset pet posto ukupne mase materije. Ima ga u svakoj zvijezdi, posebno puno vodonika u plinovitim divovima. Njegova uloga u reakcijama fuzije zvijezda je ključna. Bez vodonika nema vode, što znači da nema života. Svi se sjećaju da molekul vode sadrži jedan atom kisika, a dva atoma u njemu su vodik. Ovo je dobro poznata formula H 2 O.
Kako ga koristimo
Otkrio je vodonik 1766 Henry Cavendish kada se analizira reakcija oksidacije metala. Nakon nekoliko godina posmatranja, shvatio je da u procesu sagorijevanja vodonika nastaje voda. Ranije su naučnici izolovali ovaj element, ali ga nisu smatrali nezavisnim. Godine 1783. vodonik je dobio ime vodonik (prevedeno sa grčkog "hydro" - voda, i "gen" - rađati). Element koji stvara vodu je vodonik. To je plin čija je molekulska formula H 2 . Ako je temperatura blizu sobne temperature i pritisak je normalan, ovaj element je neprimjetan. Vodonik ne može da se uhvati čak ni ljudskim čulima - on je bez ukusa, boje i mirisa. Ali pod pritiskom i na temperaturi od -252,87 C (veoma hladno!) Ovaj gas se pretvara u tečnost. Ovako se skladišti, jer u obliku gasa zauzima mnogo više prostora. To je tečni vodonik koji se koristi kao raketno gorivo.
Vodonik može postati čvrst, metalan, ali za to je potreban ultravisok pritisak, a to sada rade najistaknutiji naučnici, fizičari i hemičari. Ovaj element već sada služi kao alternativno gorivo za transport. Primjena je slična radu motora. unutrašnjim sagorevanjem: Kada se vodonik sagori, oslobađa se mnogo njegove hemijske energije. Praktično je razvijena i metoda za stvaranje gorivne ćelije na njenoj osnovi: u kombinaciji s kisikom dolazi do reakcije, a kroz to nastaju voda i električna energija. Moguće je da će se transport uskoro "prebaciti" umjesto benzina na vodonik - mnogi proizvođači automobila zainteresovani su za stvaranje alternativnih zapaljivih materijala, a ima i uspjeha. Ali čisto vodikov motor je još uvijek u budućnosti, ima mnogo poteškoća. Međutim, prednosti su takve da je stvaranje rezervoara za gorivo sa čvrstim vodonikom u punom jeku, a naučnici i inženjeri neće odustati.

Osnovne informacije
Vodonik (lat.) - vodonik, prvi redni broj u periodnom sistemu, označen sa H. Atom vodonika ima masu 1,0079, to je gas koji nema normalnim uslovima bez ukusa, bez mirisa, bez boje. Hemičari od šesnaestog veka opisuju određeni zapaljivi gas, označavajući ga na različite načine. Ali pokazalo se za sve pod istim uslovima - kada kiselina deluje na metal. Vodonik je, čak i od samog Cavendisha, dugi niz godina jednostavno nazivan "zapaljivim vazduhom". Tek 1783. Lavoisier je sintezom i analizom dokazao da voda ima složen sastav, a četiri godine kasnije "zapaljivom vazduhu" je dao moderno ime. Korijen ovoga složenicaširoko se koristi kada je potrebno imenovati spojeve vodika i sve procese u kojima sudjeluje. Na primjer, hidrogenacija, hidrid i slično. A rusko ime je 1824. predložio M. Solovjov.
U prirodi, distribucija ovog elementa nema premca. U litosferi i hidrosferi zemljine kore njegova masa iznosi jedan posto, ali atoma vodonika čak šesnaest posto. Najčešća voda na Zemlji, sa 11,19% masenog udjela u njoj je vodonik. Također, sigurno je prisutan u gotovo svim spojevima koji čine naftu, ugalj, sve prirodne plinove, glinu. Vodonika ima u svim organizmima biljaka i životinja – u sastavu proteina, masti, nukleinske kiseline, ugljikohidrati i tako dalje. Slobodno stanje za vodonik nije tipično i gotovo se nikada ne javlja - ima ga vrlo malo u prirodnim i vulkanskim plinovima. Veoma zanemarljiva količina vodonika u atmosferi - 0,0001%, u smislu broja atoma. S druge strane, čitavi tokovi protona predstavljaju vodonik u prostoru blizu Zemlje, koji čini unutrašnji radijacijski pojas naše planete.

Prostor
U svemiru nijedan element nije tako uobičajen kao vodonik. Volumen vodonika u sastavu Sunčevih elemenata je više od polovine njegove mase. Većina zvijezda formira vodonik u obliku plazme. Glavni dio raznih plinova maglina i međuzvjezdanog medija također se sastoji od vodonika. Prisutan je u kometama, u atmosferi brojnih planeta. Naravno, ne u čista forma, - zatim kao slobodni H 2, zatim kao metan CH 4, pa kao amonijak NH 3, čak i kao voda H 2 O. Vrlo često postoje radikali CH, NH, SiN, OH, PH i sl. Kao tok protona, vodonik je dio korpuskule sunčevo zračenje i kosmičkim zracima.
U običnom vodoniku, mješavina dva stabilna izotopa je laki vodonik (ili protij 1 H) i teški vodonik (ili deuterijum - 2 H ili D). Postoje i drugi izotopi: radioaktivni tricij - 3 H ili T, inače - superteški vodonik. I također vrlo nestabilna 4 N. U prirodi, jedinjenje vodonika sadrži izotope u takvim proporcijama: ima 6800 atoma protijuma po atomu deuterija. Tricij nastaje u atmosferi iz dušika, na koji djeluju neutroni kosmičkih zraka, ali zanemarljivo. Šta znače maseni brojevi izotopa? Broj pokazuje da jezgro protijuma ima samo jedan proton, dok deuterijum ima ne samo proton, već i neutron u jezgru atoma. Tricijum ima dva neutrona u jezgru za jedan proton. Ali 4 N sadrži tri neutrona po protonu. Stoga su fizička i hemijska svojstva izotopa vodika vrlo različita u odnosu na izotope svih ostalih elemenata – razlika u masama je prevelika.

Struktura i fizička svojstva
U pogledu strukture, atom vodika je najjednostavniji u poređenju sa svim ostalim elementima: jedno jezgro - jedan elektron. Jonizacijski potencijal - energija vezivanja jezgra sa elektronom - 13,595 elektron volti (eV). Upravo zbog jednostavnosti ove strukture atom vodika je pogodan kao model u kvantnoj mehanici kada je potrebno izračunati nivoi energije složeniji atomi. U molekuli H 2 postoje dva atoma koja su povezana hemijskom kovalentnom vezom. Energija raspada je veoma visoka. Atomski vodonik može nastati u hemijskim reakcijama, kao što su cink i hlorovodonična kiselina. Međutim, interakcija s vodikom praktički ne dolazi - atomsko stanje vodika je vrlo kratko, atomi se odmah rekombiniraju u molekule H2.
Sa fizičke tačke gledišta, vodonik je lakši od svih poznatih supstanci - više od četrnaest puta lakši od vazduha (sjetite se da ste odletjeli vazdušni baloni na praznicima - unutra imaju samo vodonik). Međutim, helijum može da ključa, ukapljuje, rastopi se, učvršćuje, a samo helijum ključa i topi se na nižim temperaturama. Teško ga je rastopiti, potrebna vam je temperatura ispod -240 stepeni Celzijusa. Ali ima vrlo visoku toplotnu provodljivost. Gotovo se ne otapa u vodi, ali metal savršeno stupa u interakciju s vodonikom - otapa se u gotovo svim, a najbolje u paladiju (850 volumena se troši na jednu zapreminu vodika). Tečni vodonik je lagan i fluidan, a kada se rastvori u metalima, često uništava legure zbog interakcije sa ugljenikom (čelik, na primer), dolazi do difuzije, dekarbonizacije.

Hemijska svojstva
U jedinjenjima, uglavnom, vodonik pokazuje oksidaciono stanje (valenciju) od +1, kao natrijum i drugi alkalni metali. On se smatra njihovim analogom, koji stoji na čelu prve grupe Mendeljejevskog sistema. Ali vodikov ion u metalnim hidridima je negativno nabijen, sa oksidacijskim stanjem od -1. Takođe, ovaj element je blizak halogenima, koji su čak u stanju da ga zamene u organskim jedinjenjima. To znači da se vodonik takođe može pripisati sedmoj grupi Mendeljejevskog sistema. U normalnim uslovima, molekule vodonika se ne razlikuju po aktivnosti, kombinujući se samo sa najaktivnijim nemetalima: dobar je sa fluorom, a ako je lagan, sa hlorom. Ali kada se zagrije, vodonik postaje drugačiji - reagira s mnogim elementima. Atomski vodonik je, u poređenju sa molekularnim, hemijski veoma aktivan, pa se voda formira u vezi sa kiseonikom, a energija i toplota se oslobađaju na tom putu. Na sobnoj temperaturi ova reakcija je vrlo spora, ali kada se zagrije iznad petsto pedeset stepeni, dolazi do eksplozije.
Vodik se koristi za redukciju metala, jer oduzima kisik njihovim oksidima. Sa fluorom, vodonik stvara eksploziju čak i u mraku i na minus dvjesta pedeset i dva stepena Celzijusa. Hlor i brom pobuđuju vodonik samo kada se zagreju ili osvetle, a jod samo kada se zagreju. Vodik i dušik stvaraju amonijak (tako se proizvodi većina gnojiva). Kada se zagrije, vrlo aktivno stupa u interakciju sa sumporom i dobiva se sumporovodik. Sa telurom i selenom teško je izazvati reakciju vodonika, ali kod čistog ugljenika reakcija se odvija na veoma visokim temperaturama i dobija se metan. Sa ugljičnim monoksidom, vodonik stvara različita organska jedinjenja, ovdje djeluju tlak, temperatura, katalizatori, a sve je to od velike praktične važnosti. Generalno, uloga vodonika, kao i njegovih spojeva, izuzetno je velika, jer daje kisela svojstva protonskim kiselinama. Vodikove veze se formiraju sa mnogim elementima, što utiče na svojstva i neorganskih i organskih jedinjenja.

Dobijanje i korišćenje
Vodik se u industrijskim razmjerima dobiva iz prirodnih plinova – zapaljivih, koksnih, naftnih plinova. Može se dobiti i elektrolizom gdje struja nije preskupa. Međutim, najvažniji način proizvodnje vodika je katalitička reakcija ugljikovodika, uglavnom metana, s vodenom parom, kada se ostvaruje konverzija. Metoda oksidacije ugljikovodika kisikom također se široko koristi. Ekstrakcija vodonika iz prirodni gas je najjeftiniji način. Druga dva su upotreba plina iz koksnih peći i rafinerijskog plina - vodonik se oslobađa kada se ostale komponente ukapljuju. Lakše se ukapljuju, a za vodonik, kako se sjećamo, potrebno je -252 stepena.
Vodikov peroksid je veoma popularan. Tretman ovim rastvorom se koristi vrlo često. Molekularnu formulu H 2 O 2 teško da će nazvati svi oni milioni ljudi koji žele biti plavuše i posvijetliti kosu, kao i oni koji vole čistoću u kuhinji. Čak i oni koji tretiraju ogrebotine od igre s mačićem često ne shvaćaju da koriste tretman vodonikom. Ali svi znaju priču: od 1852. vodonik dugo vremena koristi se u aeronautici. Zračni brod koji je izumio Henry Giffard bio je zasnovan na vodoniku. Zvali su se cepelini. Cepeline su protjerane s neba brzim razvojem avionske konstrukcije. Godine 1937. dogodila se velika nesreća kada je izgorio zračni brod Hindenburg. Nakon ovog incidenta, cepelini više nisu korišćeni. Ali krajem osamnaestog veka, širenje baloni ispunjen vodonikom bio je sveprisutan. Osim za proizvodnju amonijaka, danas je vodonik potreban za proizvodnju metil alkohola i drugih alkohola, benzina, hidrogenizovanog lož ulja i čvrsto gorivo. Ne možete bez vodika pri zavarivanju, pri rezanju metala - može biti kisik-vodik i atomski-vodik. A tricij i deuterijum daju život nuklearnoj energiji. Ovo su, kao što se sjećamo, izotopi vodonika.

Neumyvakin
Vodonik je kao hemijski element toliko dobar da nije mogao a da ne ima svoje obožavatelje. Ivan Pavlovič Neumyvakin - doktor medicinskih nauka, profesor, laureat Državne nagrade i mnogih drugih titula i nagrada, među njima. Kao doktor tradicionalne medicine proglašen je za najboljeg narodnog iscjelitelja u Rusiji. Upravo je on razvio mnoge metode i principe renderiranja medicinsku njegu astronauti u letu. Upravo je on stvorio jedinstvenu bolnicu - bolnicu na svemirskom brodu. Istovremeno je bio i državni koordinator smjera kozmetičke medicine. Prostor i kozmetika. Njegova strast prema vodoniku nije usmjerena na zaradu velikih para, kao što je to sada slučaj u domaćoj medicini, već naprotiv, da nauči ljude kako da izliječe bilo šta od bukvalno novčića, bez dodatnih posjeta ljekarni.
On promoviše liječenje lijekom koji je prisutan bukvalno u svakom domu. Ovo je vodikov peroksid. Možete kritizirati Neumyvakina koliko god želite, on će i dalje insistirati na svome: da, zaista, bukvalno se sve može izliječiti vodikovim peroksidom, jer zasićuje unutrašnje ćelije tijela kisikom, uništava toksine, normalizira kiselinu i alkalnost balans, a odatle se regenerišu tkiva, podmlađuje se celo telo.organizam. Niko još nije vidio da se neko izliječi hidrogen peroksidom, a još manje ispitan, ali Neumyvakin tvrdi da se uz pomoć ovog lijeka možete potpuno riješiti virusnih, bakterijskih i gljivičnih bolesti, spriječiti razvoj tumora i ateroskleroze, pobijediti depresiju, podmladiti organizam. i nikada se ne razbolite od SARS-a i prehlade.
Univerzalni lijek
Ivan Pavlovič je siguran da pravilnom upotrebom ovog jednostavnog lijeka i uz sve jednostavne upute možete pobijediti mnoge bolesti, uključujući i one vrlo ozbiljne. Njihova lista je ogromna: od parodontalne bolesti i upale krajnika do infarkta miokarda, moždanog udara i dijabetes. Takve sitnice kao što su sinusitis ili osteohondroza odlete od prvih tretmana. Čak se i kancerogeni tumori uplaše i bježe od vodonik peroksida, jer se stimulira imunološki sistem, aktivira život tijela i njegove odbrane.
Na ovaj način se mogu liječiti čak i djeca, samo što je za trudnice za sada bolje da se suzdrže od korištenja vodikovog peroksida. Također se ne preporučuje ovu metodu osobe sa transplantiranim organima zbog moguće nekompatibilnosti tkiva. Doziranje treba strogo poštovati: od jedne kapi do deset, dodajući po jednu svaki dan. Tri puta dnevno (trideset kapi tropostotnog rastvora vodonik peroksida dnevno, vau!) pola sata pre jela. Otopinu možete unijeti intravenozno i pod nadzorom ljekara. Ponekad se vodikov peroksid kombinuje za efikasniji efekat sa drugim lekovima. Unutar otopine se koristi samo u razrijeđenom obliku - čistom vodom.

Spolja
Komprese i ispiranja bili su vrlo popularni i prije nego što je profesor Neumyvakin stvorio svoje metode. Svi znaju da se, baš kao i alkoholne obloge, vodikov peroksid ne može koristiti u čistom obliku, jer će spaliti tkiva, ali se bradavice ili gljivične infekcije podmazuju lokalno i jakim rastvorom - do petnaest posto.
Kod osipa na koži, kod glavobolje, izvode se i postupci u kojima je uključen vodikov peroksid. Kompresiju treba raditi pamučnom krpom natopljenom u rastvor od dve kašičice tri posto vodonik peroksida i pedeset miligrama čista voda. Pokrijte tkaninu folijom i umotajte vunom ili peškirom. Trajanje obloge je od četvrt sata do sat i po ujutro i uveče do oporavka.
Mišljenje lekara
Mišljenja su podijeljena, ne dive se svi svojstvima vodikovog peroksida, štoviše, ne samo da im ne vjeruju, već im se smiju. Među liječnicima ima onih koji su podržavali Neumyvakina i čak su podržali razvoj njegove teorije, ali oni su u manjini. Većina doktora takav plan liječenja smatra ne samo neefikasnim, već često i fatalnim.
Zaista, još uvijek nema službeno dokazanog slučaja kada bi se pacijent izliječio vodikovim peroksidom. Istovremeno, nema podataka o pogoršanju zdravlja u vezi s primjenom ove metode. Ali dragocjeno vrijeme je izgubljeno, a osoba koja je oboljela od jedne od teških bolesti i potpuno se pouzdala u Neumyvakinovu panaceju riskira da zakasni na početak svog pravog tradicionalnog liječenja.
Najzastupljeniji element u svemiru je vodonik. Što se tiče zvijezda, on ima oblik jezgara - protona - i materijal je za termonuklearne procese. Skoro polovinu mase Sunca čine i molekuli H2. Njegov sadržaj u zemljine kore dostiže 0,15%, a atomi su prisutni u sastavu nafte, prirodnog gasa, vode. Zajedno s kisikom, dušikom i ugljikom, on je organogeni element koji je dio svih živih organizama na Zemlji. U našem članku proučavat ćemo fizičke i Hemijska svojstva vodonika, definišemo glavne oblasti njegove primene u industriji i njegov značaj u prirodi.
Položaj u periodičnom sistemu hemijskih elemenata Mendeljejeva
Prvi element koji otvara periodni sistem je vodonik. Njegovo atomska masa je 1,0079. Ima dva stabilna (procijum i deuterijum) i jedan radioaktivni izotop (tricijum). Fizička svojstva određeno mjestom nemetala u tabeli hemijski elementi. U normalnim uslovima, vodonik (njegova formula je H2) je gas koji je skoro 15 puta lakši od vazduha. Struktura atoma elementa je jedinstvena: sastoji se samo od jezgra i jednog elektrona. Molekula tvari je dvoatomska, čestice u njoj povezane su kovalentnom nepolarnom vezom. Njegov energetski intenzitet je prilično visok - 431 kJ. Ovo objašnjava nisku hemijsku aktivnost jedinjenja u normalnim uslovima. Elektronska formula vodonik je: H:H.
Supstanca ima cela linija svojstva koja nemaju analoga među ostalim nemetalima. Hajde da razmotrimo neke od njih.
Rastvorljivost i toplotna provodljivost
Metali najbolje provode toplotu, ali im se vodonik približava po toplotnoj provodljivosti. Objašnjenje fenomena leži u veoma velikoj brzini toplotnog kretanja lakih molekula materije, pa se u atmosferi vodika zagrejani predmet hladi 6 puta brže nego u vazduhu. Jedinjenje se može dobro rastopiti u metalima, na primjer, gotovo 900 zapremina vodonika može se apsorbirati u jednoj zapremini paladijuma. Metali mogu ući u hemijske reakcije sa H 2 u kojima se manifestuju oksidaciona svojstva vodonika. U ovom slučaju nastaju hidridi:
2Na + H 2 \u003d 2 NaH.
U ovoj reakciji, atomi elementa prihvataju elektrone iz metalnih čestica, pretvarajući se u anione s jediničnim negativnim nabojem. Jednostavna tvar H 2 u ovom slučaju je oksidacijsko sredstvo, što obično nije tipično za nju.
Vodik kao redukciono sredstvo
Metale i vodonik ujedinjuje ne samo visoka toplinska provodljivost, već i sposobnost njihovih atoma u kemijskim procesima da doniraju vlastite elektrone, odnosno da se oksidiraju. Na primjer, bazični oksidi reagiraju s vodikom. Redoks reakcija završava oslobađanjem čistog metala i formiranjem molekula vode:
CuO + H 2 \u003d Cu + H 2 O.
Interakcija tvari s kisikom tijekom zagrijavanja također dovodi do stvaranja molekula vode. Proces je egzoterman i praćen je oslobađanjem veliki broj toplotnu energiju. Ako plinska mješavina H 2 i O 2 reaguje u omjeru 2: 1, tada se naziva jer eksplodira kada se zapali:
2H 2 + O 2 \u003d 2H 2 O.
Voda je i igra važnu ulogu u formiranju Zemljine hidrosfere, klime i vremena. Obezbeđuje ciklus elemenata u prirodi, podržava sve životni procesi organizme koji naseljavaju našu planetu.

Interakcija sa nemetalima
Najvažnija hemijska svojstva vodonika su njegove reakcije sa nemetalnim elementima. At normalnim uslovima dovoljno su kemijski inertni, tako da tvar može reagirati samo s halogenima, na primjer, s fluorom ili hlorom, koji su najaktivniji među svim nemetalima. Dakle, mješavina fluora i vodonika eksplodira u mraku ili na hladnoći, a s hlorom - kada se zagrije ili na svjetlu. Reakcioni proizvodi će biti halogenidi vodonika, čiji su vodeni rastvori poznati kao fluoridne i hloridne kiseline. C interaguje na temperaturi od 450-500 stepeni, pritisku od 30-100 MPa i u prisustvu katalizatora:
N₂ + 3H₂ ⇔ p, t, kat ⇔ 2NH₃.
Razmatrana hemijska svojstva vodonika imaju veliki značaj za industriju. Na primjer, možete dobiti vrijedan hemijski proizvod - amonijak. Glavna je sirovina za proizvodnju nitratne kiseline i azotnih đubriva: uree, amonijum nitrata.

organska materija
Između ugljika i vodika dolazi do proizvodnje najjednostavnijeg ugljikovodika - metana:
C + 2H 2 = CH 4.
Supstanca je najvažnija sastavni dio prirodni i Koriste se kao vrijedne vrste goriva i sirovina za industriju organske sinteze.
U hemiji ugljeničnih jedinjenja, element je uključen u ogroman broj supstanci: alkani, alkeni, ugljeni hidrati, alkoholi itd. Poznate su mnoge reakcije organskih jedinjenja sa molekulima H2. Oni nose uobičajeno ime hidrogenacija ili hidrogenacija. Dakle, aldehidi se mogu reducirati vodonikom u alkohole, nezasićeni ugljovodonici - u alkane. Na primjer, etilen se pretvara u etan:
C 2 H 4 + H 2 \u003d C 2 H 6.

Od velike su praktične važnosti takva hemijska svojstva vodonika kao što je, na primjer, hidrogenacija tečnih ulja: suncokretovog, kukuruznog i uljane repice. Dovodi do proizvodnje čvrste masti - svinjske masti koja se koristi u proizvodnji glicerina, sapuna, stearina, tvrdog margarina. Za poboljšanje izgled I ukusnost dodaju se prehrambeni proizvod, mlijeko, životinjske masti, šećer, vitamini.
U našem članku proučavali smo svojstva vodika i otkrili njegovu ulogu u prirodi i ljudskom životu.
VODNIK (lat. Hydrogenium), H, hemijski element grupe VII kratkog oblika (grupa 1 dugog oblika) periodnog sistema; atomski broj 1, atomska masa 1,00794; nemetalni. U prirodi postoje dva stabilna izotopa: protij 1 H (99,985% po težini) i deuterijum D, ili 2H (0,015%). Umjetno proizvedeni radioaktivni tricij 3 H, ili T (ß-raspad, T 1/2 12,26 godina), nastaje u prirodi u zanemarljivim količinama u gornjim slojevima atmosfere kao rezultat interakcije kosmičkog zračenja uglavnom sa N i O jezgra.Vještački dobijeni izuzetno nestabilni radioaktivni izotopi 4 H, 5 H, 6 H.
Istorijska referenca. Vodonik je prvi proučavao 1766. G. Cavendish i nazvao ga "zapaljivim vazduhom". A. Lavoisier je 1787. godine pokazao da ovaj gas formira vodu tokom sagorevanja, uvrstio ga u listu hemijskih elemenata i predložio naziv hidrogen (od grčkog?δωρ - voda i γενν?ω - rađati).
rasprostranjenost u prirodi. Sadržaj vodonika u atmosferski vazduh 3,5-10% po masi, u zemljinoj kori 1%. Glavni rezervoar vodonika na Zemlji je voda (11,19% vodonika po masi). Vodik je jedan od biogenih elemenata, deo je jedinjenja koja formiraju ugalj, naftu, prirodne zapaljive gasove, mnoge minerale itd. U svemiru blizu Zemlje, vodonik u obliku protonske struje formira unutrašnji radijacioni pojas Zemlje . Vodonik je najzastupljeniji element u svemiru; u obliku plazme čini oko 70% mase Sunca i zvijezda, glavni dio međuzvjezdanog medija i gasovitih maglina, prisutan je u atmosferi niza planeta u obliku H 2 , CH 4 , NH 3 , H 2 O, itd.
Svojstva. Konfiguracija elektronske ljuske atoma vodika je 1s 1 ; u jedinjenjima pokazuje oksidaciona stanja +1 i -1. Elektronegativnost prema Paulingu 2.1; radijusi (pm): atomski 46, kovalentni 30, van der Waals 120; energija jonizacije H° → H + 1312,0 kJ/mol. U slobodnom stanju, vodonik formira dvoatomski H 2 molekul, međunuklearna udaljenost je 76 pm, a energija disocijacije je 432,1 kJ/mol (0 K). Ovisno o međusobnoj orijentaciji nuklearnih spinova, razlikuju se orto-vodik (paralelni spinovi) i paravodonik (antiparalelni spinovi), koji se razlikuju po magnetskim, optičkim i termičkim svojstvima i obično su sadržani u omjeru 3:1. ; konverzija paravodonika u orto-vodonik troši 1418 J/mol energije.
Vodonik je gas bez boje, ukusa i mirisa; t PL -259,19 °C, t KIP -252,77 °S. Vodonik je najlakši i toplinski provodljivi od svih plinova: na 273 K, gustina je 0,0899 kg / m 3, toplotna provodljivost je 0,1815 W / (m K). Ne rastvara se u vodi; dobro se rastvara u mnogim metalima (najbolje u Pd - do 850% zapremine); difundira kroz mnoge materijale (npr. čelik). Gori na zraku, stvara eksplozivne smjese. Čvrsti vodonik kristalizira u heksagonalnoj rešetki; pri pritisku iznad 10 4 MPa moguć je fazni prijelaz sa formiranjem strukture građene od atoma i koja posjeduje metalna svojstva - tzv. metalni vodonik.
Vodonik stvara spojeve sa mnogo elemenata. S kisikom stvara vodu (na temperaturama iznad 550 ° C, reakcija je praćena eksplozijom), s dušikom - amonijak, s halogenima - vodikovi halogenidi, s metalima, intermetalima, a također i sa mnogim nemetalima (na primjer, halkogeni ) - hidridi, sa ugljikom - ugljovodonici. Reakcije sa CO su od praktične važnosti (vidi Sintetski gas). Vodik reducira okside i halogenide mnogih metala u metale, nezasićene ugljovodonike u zasićene (vidi Hidrogenacija). Jezgro atoma vodika - proton H + - određuje kisela svojstva jedinjenja. IN vodeni rastvori H + formira hidronijev ion H 3 O + sa molekulom vode. U sastavu molekula razne veze vodonik teži stvaranju vodoničnih veza sa mnogim elektronegativnim elementima.
Aplikacija. Gas vodik se koristi u industrijskoj sintezi amonijaka, hlorovodonične kiseline, metanola i viših alkohola, sintetička tečna goriva, itd., za hidrogenaciju masti i drugih organskih jedinjenja; u preradi nafte - za hidrotretman i hidrokreking frakcija nafte; u metalurgiji - za dobijanje metala (na primjer, W, Mo, Re iz njihovih oksida i fluorida), stvaranje zaštitnog okruženja u obradi metala i legura; u proizvodnji proizvoda od kvarcnog stakla uz upotrebu vodonik-kiseoničkog plamena, za atomsko-vodikovo zavarivanje vatrostalnih čelika i legura i dr., kao gas za podizanje balona. Tečni vodonik je gorivo u raketama i svemirska tehnologija; koristi se i kao rashladno sredstvo.
O glavnim metodama dobijanja, kao io skladištenju, transportu i upotrebi vodonika kao nosioca energije, pogledajte Energija vodika.
Lit. vidi u ul. Energija vodonika.
Vodonik- prvi hemijski element periodnog sistema hemijskih elemenata D.I. Mendeljejev. Hemijski element vodonik nalazi se u prvoj grupi, glavnoj podgrupi, prvom periodu periodnog sistema.
Relativna atomska masa vodonika = 1.
Vodik ima najjednostavniju strukturu atoma, sastoji se od jednog elektrona, koji se nalazi u nuklearnom prostoru. Jezgro atoma vodika sastoji se od jednog protona.
Atom vodika, u hemijskim reakcijama, može i donirati i dodati elektron, formirajući dvije vrste jona:
H0 + 1ē → H1− H0 – 1ē → H1+.
Vodonik je najzastupljeniji element u svemiru. Na njega otpada oko 88,6% svih atoma (oko 11,3% su atomi helija, udio svih ostalih elemenata zajedno je oko 0,1%). Dakle, vodonik je glavni komponenta zvijezde i međuzvjezdani plin. U međuzvjezdanom prostoru, ovaj element postoji u obliku pojedinačnih molekula, atoma i jona i može formirati molekularne oblake koji se značajno razlikuju po veličini, gustoći i temperaturi.
Maseni udio vodonika u zemljinoj kori je 1%. To je deveti najčešći element. Važnost vodonika u hemijskim procesima koji se odvijaju na Zemlji gotovo je jednako velika kao i kiseonika. Za razliku od kiseonika, koji na Zemlji postoji iu vezanom iu slobodnom stanju, praktično sav vodonik na Zemlji je u obliku jedinjenja; samo vrlo mala količina vodonika u obliku jednostavna supstanca sadržane u atmosferi (0,00005% zapremine za suvi vazduh).
Vodonik je prisutan u gotovo svim organska materija i prisutan je u svim živim ćelijama.
Fizička svojstva vodonika
Jednostavna supstanca koju formira hemijski element vodonik ima molekularnu strukturu. Njegov sastav odgovara formuli H2. Poput hemijskog elementa, jednostavna supstanca se takođe naziva vodonik.
Vodonik To je bezbojni gas, bez mirisa i ukusa, praktično nerastvorljiv u vodi. Na sobnoj temperaturi i normalno atmosferski pritisak rastvorljivost je 18,8 ml gasa na 1 litar vode.
Vodonik- najlakši plin, njegova gustina je 0,08987 g / l. Za poređenje: gustina vazduha je 1,3 g/l.
Vodonik se može rastvoriti u metalima na primjer, do 850 zapremina vodonika može se rastvoriti u jednoj zapremini paladijuma. Zbog svoje izuzetno male molekularne veličine, vodik je sposoban da difundira kroz mnoge materijale.
Kao i drugi gasovi, vodonik se kondenzuje na niskim temperaturama u bezbojnu providnu tečnost, što se dešava na temperaturi od - 252,8°C. Kada temperatura dostigne -259,2°C, vodik kristalizira u obliku bijelih kristala, sličnih snijegu.
Za razliku od kiseonika, vodonik ne pokazuje alotropiju.
Primena vodonika
Vodonik se koristi u razne industrije industrija. Mnogo vodonika ide u proizvodnju amonijaka (NH3). Dušična đubriva se dobijaju iz amonijaka, sintetička vlakna i plastike, droge.
IN Prehrambena industrija vodonik se koristi u proizvodnji margarina koji sadrži tvrde masti. Da bi se dobili iz tečnih masti, kroz njih se propušta vodonik.
Kada vodonik gori u kiseoniku, temperatura plamena je oko 2500°C. Na ovoj temperaturi, vatrostalni metali se mogu topiti i zavarivati. Dakle, vodik se koristi u zavarivanju.
Kao raketno gorivo koristi se mješavina tečnog vodonika i kisika.
Trenutno su brojne zemlje započele istraživanja o zamjeni neobnovljivih izvora energije (nafta, plin, ugalj) vodonikom. Kada se vodonik sagorijeva u kisiku, ekološki prihvatljiv čisti proizvod- voda, a ne ugljični dioksid, koji uzrokuje efekat staklene bašte.
Naučnici sugerišu da bi sredinom 21. veka trebalo da počne masovna proizvodnja automobila na vodonik. Gorivne ćelije u domaćinstvu, čiji se rad takođe zasniva na oksidaciji vodonika kiseonikom, naći će široku primenu.
Krajem 19. i početkom 20. vijeka, u zoru ere aeronautike, baloni, zračni brodovi i baloni bili su punjeni vodonikom, jer je mnogo lakši od zraka. Međutim, era zračnih brodova počela je brzo da blijedi u prošlost nakon katastrofe koja se dogodila zračnom brodu Hindenburg. 6. maja 1937. dirižabl, ispunjen vodonikom, zapalio, što je rezultiralo smrću desetina njegovih putnika.
Vodik je izuzetno eksplozivan u određenim razmerama sa kiseonikom. Nepoštivanje sigurnosnih propisa dovelo je do paljenja i eksplozije zračnog broda.
- Vodonik- prvi hemijski element periodnog sistema hemijskih elemenata D.I. Mendeljejev
- Vodonik se nalazi u grupi I, glavnoj podgrupi, period 1 Periodnog sistema
- Valencija vodika u jedinjenjima - I
- Vodonik Bezbojni gas, bez mirisa i ukusa, praktično nerastvorljiv u vodi
- Vodonik- najlakši gas
- Tečni i čvrsti vodonik nastaju na niskim temperaturama
- Vodonik se može rastvoriti u metalima
- Primjena vodonika je raznolika
Zauzima prvo mjesto u periodičnom sistemu hemijskih elemenata Mendeljejeva i označen je simbolom H.
Pročitajte članak i posjetite stranicu www.h2miraclewater-russia.ru za više informacija o vodoničnim mašinama i vodikovoj vodi.