Atom orbitalları (AO). Kvant ədədləri
Elektronun vəziyyətini təsvir edən dalğa funksiyası (7) adlanır atom orbitalı(AO).
Kvant ədədləri. Kvant mexanikasında hər bir AO üç kvant nömrəsi ilə müəyyən edilir.
Baş kvant nömrəsi n. 1-dən ∞-ə qədər tam ədədlər qəbul edə bilər. Əsas kvant nömrəsi müəyyən edir:
enerji səviyyəsinin nömrəsi;
müəyyən səviyyədə yerləşən elektronların enerji diapazonu;
orbital ölçüləri;
verilmiş enerji səviyyəsinin alt səviyyələrinin sayı (birinci səviyyə bir alt səviyyədən, ikincisi ikidən, üçüncüsü üçdən və s. ibarətdir);
Elementlərin Dövri Cədvəlində əsas kvant nömrəsinin maksimum qiyməti dövr nömrəsinə uyğun gəlir.
Orbital kvant sayı l.Elektronun orbital bucaq impulsunu (momentumunu), onun enerjisinin dəqiq qiymətini və orbitalların formasını müəyyən edir. 0, 1, 2, 3, …, (qiymətləri qəbul edə bilər) n-1).
Atom orbital– atomda elektronun ən çox ehtimal olunan mövcudluğu bölgəsini təmsil edən bir elektron dalğa funksiyasının həndəsi təsviri ψ. Elektron tapma ehtimalının müəyyən bir dəyərə malik olduğu məkan bölgəsini məhdudlaşdırır (90 ... 99%). Bəzən orbital bu bölgənin sərhəd səthi adlanır və rəsmlərdə, bir qayda olaraq, bu bölgənin kəsişməsi koordinatların başlanğıcından keçən və rəsm müstəvisində uzanan bir müstəvi ilə təsvir olunur. Atom nüvəsinin mərkəzi başlanğıcda yerləşir. "Orbit" anlayışı, "orbit"dən fərqli olaraq, elektronun dəqiq koordinatlarını bilmək demək deyil. Orbital kvant nömrəsi atom orbitalının formasını təyin edir. At l=0 kürədir, ilə l=1 – səkkiz cild (qantel), ilə l=2 – dördləçəkli rozet.
Baş kvant nömrəsinin hər bir dəyəri uyğun gəlir n orbital kvant sayı dəyərləri l(Cədvəl 1). Məsələn, əgər n=1, onda l yalnız bir dəyər alır ( l=0), n=2 – iki qiymət: 0 və 1 və s. Hər bir ədədi dəyər l orbitalların müəyyən həndəsi forması uyğun gəlir və hərf təyinatı verilir. Təyinatın ilk dörd hərfi tarixi mənşəlidir və spektral xətlərin təbiəti ilə əlaqələndirilir. s, səh, d, f– spektral xətləri adlandırmaq üçün istifadə olunan ingilis sözlərinin ilk hərfləri: kəskin, əsas, diffuz, fundamental. Digər orbitalların simvolları əlifba sırası ilə verilmişdir: g, h, …
Cədvəl 1
Əsas və orbital kvant ədədlərinin dəyərləri
| Orbital kvant sayı l | Baş kvant nömrəsi n | ||||||||||||||
| Məna Hərf təyinatı | s | s | səh | s | səh | d | s | səh | d | f | s | səh | d | f | g |
Hər hansı bir alt səviyyənin təyinatı iki kvant nömrəsi ilə müəyyən edilir - əsas (yazarkən, rəqəmsal dəyər göstərilir) və orbital (yazarkən hərf təyinatı göstərilir; orbital () ədədi dəyər iki kvant nömrəsi ilə göstərilir - əsas). Məsələn, bunun üçün enerji alt səviyyəsi n=2 və l=1, aşağıdakı kimi təyin edilməlidir: 2p-alt səviyyə. Eyni qiymətə malik bütün orbitallar l eyni həndəsi düstura malikdir və əsas kvant nömrəsinin dəyərlərindən asılı olaraq ölçüləri ilə fərqlənir. Məsələn, bunun üçün bütün orbitallar l=0 (s-orbitallar) sferik simmetrikdir və əsas kvant ədədinin qiymətindən asılı olaraq ölçüləri ilə fərqlənir. Dəyər nə qədər yüksəkdir n, orbitalların ölçüsü nə qədər böyük olarsa.
Maqnit kvant nömrəsi m l.Elektronun orbital bucaq momentumunun kosmosda sabit istiqamətə (məsələn, oxa) proyeksiyasının mümkün qiymətlərini təyin edir. z). Mənfi və müsbət dəyərləri qəbul edir l, sıfır daxil olmaqla. Qiymətlərin ümumi sayı 2-dir l+1:
Elektronun yaratdığı maqnit sahəsinin xarici maqnit sahəsi ilə qarşılıqlı təsiri maqnit kvant nömrəsinin qiymətindən asılıdır. Xarici maqnit sahəsi yoxdursa, atomdakı elektronun enerjisi ondan asılı deyil m l. Bu halda, eyni dəyərlərə malik elektronlar n Və l, lakin fərqli mənalarla m l eyni enerjiyə sahibdirlər. Xarici bir maqnit sahəsi varsa, elektronların enerjisi fərqlidir m l dəyişir.
Ümumi halda, maqnit kvant nömrəsi xarici qüvvəyə nisbətən kosmosda AO-nun istiqamətini xarakterizə edir. Maqnit kvant nömrəsi orbital bucaq momentumunun müəyyən bir sabit istiqamətə nisbətən istiqamətini təyin edir.
Mümkün dəyərlərin ümumi sayı m l fəzada verilmiş altsəviyyənin orbitallarının təşkili yollarının sayına, yəni verilmiş altsəviyyədəki orbitalların ümumi sayına uyğun gəlir (cədvəl 2).
cədvəl 2
Hər alt səviyyəyə görə orbitalların sayı
Orbital kvant sayı l=0 maqnit kvant ədədinin yeganə dəyərinə uyğundur m l=0. Bu dəyərlər l Və m l hər şeyi xarakterizə edir s-kürə formasına malik orbitallar. Bu halda maqnit kvant nömrəsi yalnız bir qiymət aldığı üçün hər s-alt səviyyə yalnız bir orbitaldan ibarətdir. Hər hansı birini nəzərdən keçirək R-alt səviyyə. At l=1 orbitallar dumbbell formasına malikdir (həcm səkkizlər), maqnit kvant nömrəsi aşağıdakı dəyərləri alır: m l= -1, 0, +1. Beləliklə, R-alt səviyyə təyin olunduqları koordinat oxları boyunca yerləşən üç AO-dan ibarətdir; p x, p y, p z müvafiq olaraq (şək. 1).
düyü. 1. s- və p-atom orbitallarının fəza forması.
üçün d-alt səviyyə l=2, m l= -2, -1, 0, +1, +2 (cəmi 5 dəyər) və hər hansı d-alt səviyyə kosmosda müəyyən şəkildə yerləşmiş beş atom orbitalından ibarətdir (şəkil 2) və müvafiq olaraq təyin olunur.
düyü. 2. d-atom orbitallarının fəza forması.
Beşdən dördü d- orbitallar dörd loblu rozetlərin formasına malikdir, hər biri iki dumbbelldən əmələ gəlir, beşinci AO ekvator müstəvisində (-orbital) bir torus olan dumbbelldir və ox boyunca yerləşir. z. Orbital loblar x və y oxları boyunca yerləşir. Orbital loblar müvafiq oxlar arasında simmetrik olaraq yerləşir.
Dördüncü enerji səviyyəsi dörd alt səviyyədən ibarətdir - s, səh, d Və f. Onlardan ilk üçü yuxarıda təsvir edilənlərə bənzəyir, dördüncüsü isə f-alt səviyyə yeddi AO-dan ibarətdir, onların məkan forması kifayət qədər mürəkkəbdir və bu bölmədə müzakirə olunmur.
S. Qudsmit və J. Uhlenbeck 1925-ci ildə hidrogen atomunun spektrində bəzi incə təsirləri təsvir etmək üçün elektronun öz bucaq impulsunun mövcudluğu fərziyyəsini irəli sürdülər. fırlatmaq. Spin koordinatlar və momentlərlə ifadə edilə bilməz; onun klassik mexanikada analoqu yoxdur. Spin nömrəsi s elektron spin vektorunun xarici sahənin müəyyən istiqamətinə proyeksiyasına bərabər yalnız bir qiymət alır (məsələn, oxa z) müəyyən edilir spin kvant nömrəsiXanım , iki dəyər ala bilər: Xanım =
“Spin” anlayışı elektronun spesifik kvant xassəsini xarakterizə etmək üçün təqdim edilmişdir. Spin mikroskopik səviyyədə relativistik təsirlərin təzahürüdür.
Elektronun dörd sərbəstlik dərəcəsi var. Spin kvant nömrəsi yalnız diskret dəyərləri qəbul edir: Beləliklə, bir atomdakı elektronun vəziyyəti dörd kvant ədədinin dəyərlər dəsti ilə müəyyən edilir: n, l, m l, Xanım.
Elektron enerji səviyyələrinin təyini və quruluşu. Kvant ədədlərinin fiziki mənasını izah etmək üçün istifadə olunan bəzi terminləri müəyyən edək. Eyni orbital kvant sayına malik orbitallar qrupu enerji alt səviyyəsi. Baş kvant ədədinin eyni qiyməti olan bütün orbitalların çoxluğu əmələ gəlir enerji səviyyəsi.
Atom elektron səviyyələrinin quruluşu iki şəkildə təsvir edilə bilər: elektron düsturlar və elektron difraksiya diaqramları şəklində. Elektron düsturları yazarkən iki kvant ədədi n və l istifadə olunur: birinci səviyyə 1-dir s; ikinci - 2 s, 2səh; üçüncü - 3 s, 3səh, 3d; dördüncü - 4 s, 4səh, 4d, 4f və s. (Cədvəl 3).
Cədvəl 3
Atomun elektron enerji səviyyələrinin quruluşu
Elektron səviyyələrin strukturu üç kvant rəqəmindən istifadə etməklə daha dolğun təsvir edilmişdir: n, l, m l. Hər bir ASC şərti olaraq kvant hüceyrələri şəklində təsvir olunur, bunun yanında səviyyə nömrəsi və alt səviyyə simvolu yerləşdirilir.
Elektron ikili təbiətə malikdir: müxtəlif təcrübələrdə hissəcik və dalğanın xüsusiyyətlərini nümayiş etdirə bilər. Bir hissəcik kimi elektronun xassələri: kütlə, yük; dalğa xüsusiyyətləri-hərəkət, müdaxilə və difraksiya xüsusiyyətlərində.
Elektronun hərəkəti qanunlara tabedir kvant mexanikası .
Bir elektronun nüvə ətrafında hərəkətini təyin edən əsas xüsusiyyətlər: müvafiq orbitalın enerji və fəza xüsusiyyətləri.
Qarşılıqlı əlaqə zamanı (üst-üstə düşən) atom orbitalları(SC ) iki və ya daha çox atoma aid olan əmələ gəlir molekulyar orbitallar(MO).
Molekulyar orbitallar ortaq elektronlarla doldurulur və həyata keçirilir kovalent bağ.
Molekulyar orbitalların meydana gəlməsindən əvvəl ola bilər bir atomun atom orbitallarının hibridləşməsi.
Hibridləşmə - kovalent bağın əmələ gəlməsi zamanı bəzi orbitalların formasını dəyişdirərək onları daha effektiv şəkildə üst-üstə düşür. Eyni hibridlər əmələ gəlir ASC təhsildə iştirak edənlər MO, digər atomların atom orbitallarının üst-üstə düşməsi. Hibridləşmə yalnız kimyəvi bağlar əmələ gətirən atomlar üçün mümkündür, sərbəst atomlar üçün isə mümkün deyil.

Karbohidrogenlər
Əsas suallar:
- Karbohidrogenlər. Təsnifat. Nomenklatura.
- Struktur. Xüsusiyyətlər.
- Karbohidrogenlərin tətbiqi.
Karbohidrogenlər- iki elementdən ibarət olan üzvi birləşmələr sinfi: karbon və hidrogen.


İzomerləri və homoloqları seçin:

Alkanları adlandırın:
 ____________________________________________
____________________________________________
 __________________________________________
__________________________________________

Ä nitrasiya reaksiyası (Konovalov reaksiyası, 1889) bir nitro qrupu ilə hidrogen əvəzetmə reaksiyasıdır.
Şərtlər: 13% HNO 3, t = 130 – 140 0 C, P = 15 – 10 5 Pa. Sənaye miqyasında alkanların nitrasiyası qaz fazasında 150 – 170 0 C-də azot oksidi (IV) və ya azot turşusu buxarı ilə aparılır.
CH 4 + H2O – NO 2 → CH 3 – NO 2 + H 2 O
nitrometan
@ Tapşırıqları həll edin:
1. Alkanların tərkibi ümumi düsturla əks olunur:
a) C n H 2 n +2; b) C n H 2 n -2; c) C n H 2 n; d) C n H 2 n -6 .
2. Alkanlar hansı reagentlərlə reaksiya verə bilər:
A) Br 2 (məhlul); b) Br 2, t 0; V) H 2 SO 4; G) HNO 3 (seyreltilmiş), t 0 ; d) KMnO 4; e) CON?
Cavablar: 1) reagentlər a, b, d, d; 2) reagentlər b, c, f;
3) reagentlər b, d; 4) reagentlər b, d, d, f.
- Reaksiya növü ilə reaksiya sxemi (tənliyi) arasında uyğunluq qurun:
- Metanın tam xlorlanması zamanı əmələ gələn maddəni göstərin:
a) triklorometan; b) karbon tetraklorid; c) diklorometan; d) tetraxloroetan.
- 2,2,3-trimetilbutanın monobrominasiyasının ən çox ehtimal olunan məhsulunu göstərin:
a) 2-bromo-2,3,3-trimetilbutan; b) 1-bromo-2,2,3-trimetilbutan;
c) 1-bromo-2,3,3-trimetilbutan; d) 2-bromo-2,2,3-trimetilbutan.
Reaksiya üçün tənlik yazın.
Wurtz reaksiyası – karbohidrogenlərin halogen törəmələrinə metal natriumun təsiri. İki müxtəlif halogen törəməsi reaksiya verdikdə, distillə yolu ilə ayrıla bilən karbohidrogenlərin qarışığı əmələ gəlir.
| CH 3 I + 2 Na + CH 3 I → C 2 H 6 + 2 NaI |
@ Tapşırıqları həll edin:
1. Bromoetanı natrium metalı ilə qızdırdıqda əmələ gələn karbohidrogenin adını göstərin:
a) propan; b) butan; c) pentan; d) heksan; e) heptan.
Reaksiya üçün tənlik yazın.
- Metal natrium qarışığa təsir etdikdə hansı karbohidrogenlər əmələ gəlir:
a) yodometan və 1-bromo-2-metilpropan; b) 2-bromopropan və 2-bromobutan?
Sikloalkanlar
1. Kiçik dövrələr üçün (C 3 – C 4) xarakterikdir əlavə reaksiyalar hidrogen, halogenlər və hidrogen halidləri. Reaksiyalar dövrün açılması ilə müşayiət olunur.
2. Digər dövrlər üçün (5 və yuxarıdan) tipik əvəzetmə reaksiyaları.

Doymamış karbohidrogenlər(doymamış):
| Alkenlər (olefinlər, ikiqat rabitəli doymamış karbohidrogenlər, etilen karbohidrogenləri): Struktur: sp 2 -hibridləşmə, orbitalların planar düzülüşü (düz kvadrat). Reaksiyalar:əlavə (hidrogenləşmə, halogenləşmə, hidrohalogenləşmə, polimerləşmə), əvəzetmə (səciyyəvi deyil), oksidləşmə (yanma, KMnO 4), parçalanma (oksigenə giriş olmadan). |  |
 |  |
 |  |
@ Tapşırıqları həll edin:
- Alken molekulunda karbon atomlarının hibridləşməsi nədir:
![]()
a) 1 və 4 – sp 2, 2 və 3 – sp 3; b) 1 və 4 – sp 3, 2 və 3 – sp 2;
c) 1 və 4 – sp 3, 2 və 3 – sp; d) 1 və 4 – hibridləşməmiş, 2 və 3 – sp 2.
2. Alkeni adlandırın:


- Nümunə olaraq 1-butendən istifadə edərək reaksiya tənliklərini tərtib edin və nəticədə alınan məhsulları adlandırın.

4. Aşağıdakı transformasiya sxemində reaksiyada etilen əmələ gəlir:
a) 1 və 2; b) 1 və 3; c) 2 və 3;
d) heç bir reaksiyada etilen əmələ gəlmir.
- Hansı reaksiya Markovnikovun qaydasına ziddir:
a) CH 3 – CH = CH 2 + HBr →; b) CH 3 – CH = CH 2 + H 2 O →;;
c) CH 3 – CH = CH – CH 2 + HCI →; d) CCI 3 – CH = CH 2 + HCI →?

þ Konjuge bağları olan dienlər:hidroliz 1,3-butadien – 2-buten əmələ gəlir (1,4-əlavə):
þ hidrogenləşmə katalizator Ni-butanın iştirakı ilə 1,3-butadien:
þ halogenləşmə 1,3-butadien – 1,4-əlavə (1,4 – dibromo-2-buten):
þ dienlərin polimerləşməsi:


Polienlər(çoxlu qoşa rabitəli doymamış karbohidrogenlər) molekullarında ən azı üç qoşa bağ olan karbohidrogenlərdir.
Dienlərin hazırlanması:
Ø alkali spirt məhlulunun təsiri:
Ø Lebedev üsulu (divinil sintezi):
Ø qlikolların susuzlaşması (alkandiollar):
| Alkinlər (asetilen karbohidrogenləri, bir üçlü bağı olan karbohidrogenlər): Struktur: sp hibridləşməsi, orbitalların xətti düzülüşü. Reaksiyalar:əlavə (hidrogenləşmə, halogenləşmə, hidrohalogenləşmə, polimerləşmə), əvəzetmə (duzların əmələ gəlməsi), oksidləşmə (yanma, KMnO 4), parçalanma (oksigenə giriş olmadan). |  5-metilheksin-2
1-pentin 3-metilbutin-1 5-metilheksin-2
1-pentin 3-metilbutin-1
|
|||
 | 1. Hansı karbohidrogenlər C n H 2n-2 ümumi düsturuna uyğundur: a) asetilen, dien; b) etilen, dien; c) sikloalkanlar, alkenlər; d) asetilen, aromatik? 2. Üçlü istiqraz aşağıdakıların birləşməsidir: a) üçσ rabitəsi; b) bir σ-ratiq və iki π-istiqraz; c) iki σ-istiqamət və bir π- rabitə; d) üçπ bağı. 3. 3-metilpentin -3 üçün düstur yaradın. | |||
| I. Əlavə reaksiyalar | ||||
| v Hidrogenləşmə alkenlərin əmələ gəlmə mərhələsindən keçir: | ||||
| v Halojenlərin əlavə edilməsi alkenlərdən daha pis olur: Alkinlər brom suyunu rəngləndirir ( keyfiyyət reaksiyası). | ||||
| v Hidrogen halidlərinin əlavə edilməsi: | ||||
| Qeyri-simmetrik alkinlərə əlavə məhsullar müəyyən edilir Markovnikov qaydası: | ||||
| v Su əlavə etmək (nəmləndirmə)– M.G.Kucherovun reaksiyası, 1881. | ||||
| Asetilen homoloqları üçün suyun əlavə edilməsinin məhsulu ketondur: | ||||
| III. Duzların əmələ gəlməsi (turşu xassələri) – əvəzetmə reaksiyaları | ||||
| ð Aktiv metallarla qarşılıqlı əlaqə: Asetilenidlər homoloqların sintezi üçün istifadə olunur. | ||||
| ð Alkinlərin gümüş oksidin və ya mis (I) xloridin ammonyak məhlulları ilə qarşılıqlı təsiri: | ||||
| Son üçlü bağa keyfiyyətli reaksiya - gümüş asetilidin və ya qırmızı-qəhvəyi mis (I) asetilidin bozumtul-ağ çöküntünün əmələ gəlməsi: | HC ≡ CH + CuCI → CuC ≡ CCu ↓ + 2HCI Heç bir reaksiya baş vermir | |||
| IV. Oksidləşmə reaksiyaları | ||||
| Yüngül oksidləşmə- kalium permanganatın sulu məhlulunun rənginin dəyişməsi ( çoxlu birləşməyə keyfiyyətli cavab): | Asetilen KMnO 4-ün seyreltilmiş məhlulu ilə reaksiya verdikdə (otaq temperaturu) - oksalat turşusu. | |||
Orbitallar elektronun onlarda (işğal edilmiş orbitallar) və ya olmamasından (boş orbitallar) asılı olmayaraq mövcuddur. Hidrogenlə başlayan və bu gün əldə edilən sonuncu elementlə bitən hər bir elementin atomu bütün elektron səviyyələrdə bütün orbitalların tam dəstinə malikdir. Atom nömrəsi, yəni nüvənin yükü artdıqca onlar elektronlarla doldurulur.
s-Yuxarıda göstərildiyi kimi orbitallar sferik formaya və buna görə də hər üçölçülü koordinat oxu istiqamətində eyni elektron sıxlığına malikdir:
Hər atomun ilk elektron səviyyəsində yalnız bir atom var s- orbital. Əlavə olaraq ikinci elektron səviyyədən başlayaraq s-üç orbital da görünür R-orbitallar. Onlar üçölçülü səkkizlərə bənzəyir, ən çox ehtimal olunan yerin sahəsi belə görünür R-atom nüvəsinin bölgəsindəki elektron. Hər biri R-orbital üç qarşılıqlı perpendikulyar oxdan biri boyunca yerləşir, buna uyğun olaraq adda R-orbitallar müvafiq indeksdən istifadə edərək onun maksimum elektron sıxlığının yerləşdiyi oxu göstərir:
Müasir kimyada orbital kimyəvi bağların əmələ gəlməsi proseslərini nəzərdən keçirməyə və onların xassələrini təhlil etməyə imkan verən müəyyən bir anlayışdır, eyni zamanda kimyəvi bağların formalaşmasında iştirak edən elektronların orbitallarına, yəni valentliyə diqqət yetirilir. elektronlar, adətən sonuncu səviyyənin elektronları.
İlkin vəziyyətdə olan karbon atomu ikinci (son) elektron səviyyədə iki elektrona malikdir. s-orbitallar (mavi ilə işarələnmiş) və ikidə bir elektron R-orbitallar (qırmızı və sarı ilə işarələnmiş), üçüncü orbitaldır p z- boş:
Hibridləşmə.
Bir karbon atomu doymuş birləşmələrin əmələ gəlməsində iştirak etdikdə (çox bağı olmayan) bir s- orbital və üç R-orbitallar birləşərək orijinal orbitalların hibridləri olan yeni orbitallar əmələ gətirir (proses hibridləşmə adlanır). Hibrid orbitalların sayı həmişə orijinalların sayına bərabərdir, bu halda dörddür. Yaranan hibrid orbitallar eyni formadadır və zahirən asimmetrik üçölçülü səkkiz rəqəmə bənzəyir:
Bütün quruluş nizamlı tetraedrdə - nizamlı üçbucaqlardan yığılmış prizmada yazılmış kimi görünür. Bu zaman hibrid orbitallar belə tetraedrin oxları boyunca yerləşir, istənilən iki ox arasındakı bucaq 109°-dir. Karbonun dörd valent elektronu bu hibrid orbitallarda yerləşir:
Sadə kimyəvi bağların əmələ gəlməsində orbitalların iştirakı.
Dörd eyni orbitalda yerləşən elektronların xüsusiyyətləri ekvivalentdir, eyni tipli atomlarla qarşılıqlı əlaqədə olduqda bu elektronların iştirakı ilə yaranan kimyəvi bağlar ekvivalent olacaqdır.
Karbon atomunun dörd hidrogen atomu ilə qarşılıqlı təsiri karbonun uzunsov hibrid orbitallarının hidrogenin sferik orbitalları ilə qarşılıqlı üst-üstə düşməsi ilə müşayiət olunur. Hər bir orbital üst-üstə düşmə nəticəsində bir elektron ehtiva edir, hər bir cüt elektron birləşmiş molekulyar orbital boyunca hərəkət etməyə başlayır.
Hibridləşmə yalnız bir atom daxilində orbitalların formasının dəyişməsinə, iki atomun (hibrid və ya adi) orbitallarının üst-üstə düşməsi isə onlar arasında kimyəvi əlaqənin yaranmasına səbəb olur. Bu halda ( santimetr. Aşağıdakı şəkil) maksimum elektron sıxlığı iki atomu birləşdirən xətt boyunca yerləşir. Belə bir əlaqə s-əlaqə adlanır.
Yaranan metanın strukturunun ənənəvi yazısı üst-üstə düşən orbitallar əvəzinə valent zolağı simvolundan istifadə edir. Quruluşun üçölçülü təsviri üçün rəsm müstəvisindən izləyiciyə yönəldilmiş valentlik bərk paz şəkilli xətt şəklində, rəsm müstəvisindən kənara çıxan valentlik isə kəsikli paz şəklində göstərilir. -şəkilli xətt:
Beləliklə, metan molekulunun quruluşu karbonun hibrid orbitallarının həndəsəsi ilə müəyyən edilir:
Etan molekulunun əmələ gəlməsi yuxarıda göstərilən prosesə bənzəyir, fərq ondadır ki, iki karbon atomunun hibrid orbitalları üst-üstə düşəndə C-C rabitəsi yaranır:
Etan molekulunun həndəsəsi metana bənzəyir, əlaqə bucaqları 109°-dir ki, bu da karbon hibrid orbitallarının fəza düzülüşü ilə müəyyən edilir:
Orbitalların çoxsaylı kimyəvi bağların əmələ gəlməsində iştirakı.
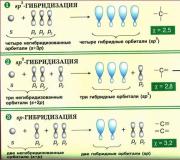
Etilen molekulu da hibrid orbitalların iştirakı ilə əmələ gəlir, lakin hibridləşmədə yalnız biri iştirak edir. s-orbital və yalnız iki R-orbitallar ( p x Və RU), üçüncü orbital - p z, ox boyunca yönəldilmişdir z, hibridlərin əmələ gəlməsində iştirak etmir. İlkin üç orbitaldan eyni müstəvidə yerləşən, üç şüalı ulduz əmələ gətirən üç hibrid orbital yaranır, oxlar arasındakı açılar 120°-dir:
İki karbon atomu dörd hidrogen atomunu birləşdirir və eyni zamanda bir-birinə bağlanaraq C-C s-bağ əmələ gətirir:
İki orbital p z hibridləşmədə iştirak etməmiş, bir-birini üst-üstə düşür, onların həndəsəsi elədir ki, üst-üstə düşmə C-C rabitə xətti boyunca deyil, onun üstündə və altında baş verir. Nəticədə, bu bağın formalaşmasında iştirak edən iki elektronun (mavi və qırmızı ilə işarələnmiş) yerləşdiyi artan elektron sıxlığı olan iki bölgə meydana gəlir. Beləliklə, kosmosda ayrılmış iki bölgədən ibarət bir molekulyar orbital yaranır. Maksimum elektron sıxlığının iki atomu birləşdirən xəttdən kənarda yerləşdiyi bağa p rabitəsi deyilir:
Əsrlər boyu doymamış birləşmələri təsvir etmək üçün geniş istifadə olunan ikiqat bağın təyin edilməsində ikinci valentlik xüsusiyyəti müasir anlayışda C-C rabitə xəttinin əks tərəflərində yerləşən artan elektron sıxlığı olan iki bölgənin mövcudluğunu nəzərdə tutur.
Etilen molekulunun quruluşu hibrid orbitalların həndəsəsi ilə müəyyən edilir, H-C-H əlaqə bucağı 120 ° -dir:
Asetilenin əmələ gəlməsi zamanı bir s-orbital və bir p x-orbital (orbitallar p y Və p z, hibridlərin əmələ gəlməsində iştirak etmirlər). Yaranan iki hibrid orbital ox boyunca eyni xəttdə yerləşir X:
Hibrid orbitalların bir-biri ilə və hidrogen atomlarının orbitalları ilə üst-üstə düşməsi sadə valentlik xətti ilə təmsil olunan C-C və C-H s-bağlarının yaranmasına səbəb olur:
Qalan iki cüt orbital p y Və p züst-üstə düşmək. Aşağıdakı şəkildə, rəngli oxlar göstərir ki, sırf məkan mülahizələrinə əsasən, eyni indekslərlə orbitalların üst-üstə düşməsi ehtimalı yüksəkdir. x-x Və ooh. Nəticədə, sadə s-istiqrazı C-C ətrafında iki p-istiqrazı əmələ gəlir:
Nəticədə, asetilen molekulu çubuq formasına malikdir:
Benzolda molekulyar onurğa birdən ibarət hibrid orbitalları olan karbon atomlarından yığılır. s- və iki R-üç şüalı ulduz şəklində düzülmüş orbitallar (etilen kimi), R-hibridləşmədə iştirak etməyən orbitallar yarı şəffaf göstərilir:
Kimyəvi bağların əmələ gəlməsində boş orbitallar, yəni elektron () olmayanlar da iştirak edə bilər.
Yüksək səviyyəli orbitallar.
Dördüncü elektron səviyyədən başlayaraq atomların beşi var d-orbitallar, onların elektronlarla doldurulması skandiyumdan başlayaraq keçid elementlərində baş verir. dörd d-orbitallar bəzən “yonca yarpaqları” adlanan üçölçülü dördyarpaqlı yonca şəklinə malikdirlər, onlar yalnız kosmosda oriyentasiya ilə fərqlənirlər, beşinci d-orbital bir halqaya yivlənmiş üç ölçülü səkkiz rəqəmdir:
d-Orbitallar ilə hibridlər meydana gələ bilər s- Və p- orbitallar. Seçimlər d-orbitallardan adətən keçid metal komplekslərinin strukturunun və spektral xassələrinin təhlilində istifadə olunur.
Altıncı elektron səviyyədən başlayaraq atomların yeddisi var f-orbitallar, onların elektronlarla doldurulması lantanidlərin və aktinidlərin atomlarında baş verir. f-Orbitalların kifayət qədər mürəkkəb konfiqurasiyası var, aşağıdakı şəkildə eyni formaya malik olan və kosmosda müxtəlif yollarla istiqamətlənmiş yeddi belə orbitaldan üçünün forması göstərilir:
f-Müxtəlif birləşmələrin xassələrini müzakirə edərkən orbitallardan çox nadir hallarda istifadə olunur, çünki onların üzərində yerləşən elektronlar praktiki olaraq kimyəvi çevrilmələrdə iştirak etmirlər.
Perspektivlər.
Səkkizinci elektron səviyyədə doqquz var g-orbitallar. Bu orbitallarda elektronları olan elementlər mövcud olmadığı halda səkkizinci dövrdə peyda olmalıdır (dövri sistemin yeddinci dövrünün sonuncu elementi olan 118 nömrəli elementin yaxın gələcəkdə alınması gözlənilir; onun sintezi aparılır. Dubnadakı Birgə Nüvə Tədqiqatları İnstitutunda).
forma g-Kvant kimyası üsulları ilə hesablanan orbitallar, orbitallardan daha mürəkkəbdir f-orbitallar, bu vəziyyətdə elektronun ən çox yerləşdiyi bölgə çox qəribə görünür. Aşağıda doqquz belə orbitaldan birinin görünüşü verilmişdir:
Müasir kimyada atom və molekulyar orbital anlayışlarından birləşmələrin quruluşunu və reaksiya xassələrini təsvir etmək, həmçinin müxtəlif molekulların spektrlərini təhlil etmək, bəzi hallarda reaksiyaların baş vermə ehtimalını proqnozlaşdırmaq üçün geniş istifadə olunur.
Mixail Levitski
ORBİTAL
ORBİTAL, in ELEMENTARY PARTICLE PHYSICS - ELEKTRONLARIN hərəkət edə bildiyi atom NÜKLƏSİ ətrafındakı fəzanın səthi. Belə bir orbitalda elektronun olma ehtimalı yüksəkdir. Bir və ya iki elektron ola bilər. Orbital atomun KVANT SAYININA uyğun gələn forma və enerjiyə malikdir. Molekullarda bağ elektronları bütün nüvələrin birləşmiş elektrik sahəsində hərəkət edir. Bu halda atom orbitalları molekulyar orbitallara, xarakterik enerjiyə malik olan və iki elektron ehtiva edən iki nüvəni əhatə edən bölgələrə çevrilir. Atom orbitallarından əmələ gələn bu molekulyar orbitallar KİMYİ BAĞLAR əmələ gətirir.
Atom orbitalları, çox güman ki, elektronları ehtiva edən bir atomun nüvəsi ətrafındakı səthi təsvir edir. Onları "enerji buludları" da adlandırmaq olar. Onların mövcudluğu kimyəvi bağları izah edir. Elektronlar enerji səviyyələrində təşkil edilmiş atom və ya molekulyar strukturların içərisindədir. Birinci səviyyə yalnız bir elektron növü ilə xarakterizə olunur: atomun x, y və z oxlarına nisbətən göstərilən bir s-orbital (A) var. Bu enerji səviyyəsində ola biləcək elektronların maksimum sayı ikidir. İkinci növ elektronlar üçün orbital nüvəyə nisbətən simmetrik olaraq yerləşən iki bağlı sferanın formasına malikdir. Belə orbital p-orbital (B) V atomu adlanır və onlar bir-birinə düz bucaq altında yerləşirlər (1,2, 3). şəklin aydınlığı. Bundan əlavə, hər biri G nüvəsində kəsişən iki perpendikulyar oxda dörd armud formalı lobdan ibarət olan beş d-orbital (C-G) var - iki p-orbitalın birləşməsi.
Elmi-texniki ensiklopedik lüğət.
Digər lüğətlərdə "ORBITAL" nə olduğuna baxın:
Orbital: Atom orbitalı. Molekulyar orbital. Müvafiq məqalələrə keçidləri olan bir söz və ya ifadənin mənalarının siyahısı. Buraya... Vikipediyadan gəlmisənsə
orbital- – nuklidlər sahəsində yerləşən elektronun dalğa funksiyalarının tam toplusu və eyni nuklidlərlə qarşılıqlı təsirdə olan bütün digər elektronların orta sahəsi. Atom orbitalı bir atomda elektronun icazə verilən vəziyyətidir, həndəsi təsvirdir... ... Kimyəvi terminlər
Atom və ya molekulyar nüvənin sahəsində yerləşən elektronun dalğa funksiyası mənasını daşıyan bir elektronun məkan dəyişənlərinin funksiyası. Belə bir funksiya spin elektronunu nəzərə alırsa, o zaman çağırılır. spin O. Daha ətraflı məlumat üçün baxın Molekulyar orbital...... Fiziki ensiklopediya
orbital- orbital. fiziki Bir və ya bir neçə atom nüvəsi sahəsində və sözügedən atom və ya molekulun bütün digər elektronlarının orta sahəsində yerləşən elektronun atom və molekulyar dalğa funksiyaları. NES 2000… Rus dilinin Gallicisms tarixi lüğəti
- (lat. orbita yolu, yoldan), atom, molekul və ya digər kvant sistemində bir elektronun vəziyyətini təsvir edən dalğa funksiyası. Ümumi halda, kvant kimyası. O. termini birinin x, y, z dəyişənlərindən asılı olan hər hansı bir funksiya üçün istifadə olunur ... ... Kimya ensiklopediyası
orbital- orbital statusas T sritis chemija apibrėžtis Banginė funkcija, apibūdinanti elektrono judėjimą atom arba molekulėje; erdvė, kurioje elektron buvimas labiausiai tikėtinas. attikmenys: ingilis. orbital rus. orbital... Chemijos terminų aiškinamasis žodynas
orbital- orbitalė statusas T sritis fizika attikmenys: engl. orbital vok. Orbital, n rus. orbital, f pranc. orbitale, f … Fizikos terminų žodynas
orbital- orbit al və... Rus orfoqrafiya lüğəti
orbital- İlə. Orbit buença başkarıl torgan. Orbit buencha hәrәkәt itә torgan yaki shunyn өchen bilgelәngәn… Tatar telen anlatmaly suzlege
orbital- Effektiv atom və ya molekulyar nüvə sahəsində fərdi elektronun dalğa funksiyası mənasını daşıyan bir elektronun məkan dəyişənlərinin funksiyası ... Politexnik terminoloji izahlı lüğət
Kitablar
- Kosmik fəlsəfə lüğəti, Seklitova L.A. , Bu lüğətə ezoterik ədəbiyyatda ən çox rast gəlinən söz və anlayışlar daxildir. Onun tərtib edilməsi zərurəti ondan irəli gəlir ki, bir çox tanınmış... Kateqoriya: Sağlamlıq və şəxsi inkişaf Serial: Naməlumdan kənar Nəşriyyat: Amrita-Rus,
- Kosmik Fəlsəfə Lüğəti, Seklitova Larisa Aleksandrovna, Strelnikova Lyudmila, Bu lüğətə ezoterik ədəbiyyatda ən çox rast gəlinən söz və anlayışlar daxildir. Onun tərtib edilməsi zərurəti ondan irəli gəlir ki, bir çox tanınmış... Kateqoriya:
Gözəllik bizdən gizlidir
Hər biri üçün gözəldir.
Siseron
“Biz” kimik və onlar bizdən nəyi gizlədirlər? Kimyaçılar haqqında danışacağıq, lakin bu, hər kəsə aiddir. Səyahətimiz zamanı gizli məqsədə tez çatmaq üçün bizə bələdçi kitabçası və ya ərazinin xəritəsi lazımdır. Kimyaçının həmişə belə bir bələdçisi var - bu dövri cədvəldir. Bu masa əlinizdə olarsa, sonrakı hekayə daha maraqlı olacaq.
Təsəvvür edin ki, siz daim qeyri-adi və maraqlı məlumatlar öyrəndiyiniz maraqlı bir insanla tanış oldunuz. Əvvəlcə maraqlı məlumat almaq kifayət edəcək, lakin tədricən bu insanın özü ilə maraqlanacaqsınız. Onun zövqlərini, baxışlarını, sevgilərini, necə yaşadığını bilmək istəyəcəksiniz.
Məqaləmizdə elektronlar məlumat verir. Kimyəvi elementlərin əmələ gətirdiyi maddələrin davranışını və onların kimyəvi çevrilmələrinin sonsuz müxtəlifliyini müəyyən edən məhz onlardır (ilk növbədə valent elektronlar). Elektronların yaşadıqları şərtləri nəzərdən keçirək. Demək olmaz ki, kimsə öz evinin memarlığını bizdən gizlədir, amma əsl mənzərəni az adam bilir.
Təbiət əla dizaynerdir
Xatırladaq ki, atom və ya molekulda elektronun tutduğu fəza bölgəsi orbital adlanır. Təkcə orbitallar anlayışının özü tanış və hətta populyarlaşdı, həm də onların bəzən kitab üzlüklərində görünə bilən görünüşü. Məsələn, məktəb kimya dərsliklərindən birinin üz qabığında su molekulunun diaqramı, oxşar süjetdə isə metan molekulunun diaqramı verilmişdir (şək. 1).
Hər iki dizayn çox cəlbedicidir. Uzunsov şarlara bənzəyən tetraedrin daxilində yerləşən orbitallar sferik orbitallarla təmasdadır.
Metan molekulunda molekulyar orbitallar var, lakin biz daha sadə obyektlərə - atom orbitallarına diqqət yetirəcəyik. Kimyəvi bağlarla əlaqəsi olmayan təcrid olunmuş atomlarda elektronlar harada yerləşir? Göstərilən şəkillərə heyran olduqdan sonra emosiyaları bir kənara qoyub kədərli bir qeyd əlavə edək - metandakı həqiqi molekulyar orbitallar əksər şəkillərdə göstərilənlərdən xeyli fərqlənir. Bunun niyə baş verdiyini bir az sonra danışacağıq.
Onlar həqiqətən necədirlər?
Beləliklə, elektron nüvənin ətrafında sabit bir xətt - orbit boyunca deyil, müəyyən bir məkan bölgəsini tutur. Əvvəllər "orbit" terminindən istifadə edirdilər, lakin tədricən orbitin (lat. orbita– track) fəzada bir xəttdir. Məsələn, planetimiz Yerin orbitində Günəş ətrafında hərəkət edir. Elektronun yerləşdiyi bölgə xətt deyil, kosmosun müəyyən həcmli hissəsidir, buna görə də "orbital" termini istifadə olunmağa başladı. “Orbital” anlayışının unikallığı ondan ibarətdir ki, kosmosun bu hissəsinin aydın sərhədləri yoxdur, bulanıqdır. Məsələn, hidrogen atomunda bir elektron (şəkil 2a) müəyyən bir ehtimalla nüvəyə çox yaxın və ya xeyli məsafədə ola bilər (elektronun təsadüfi yerini göstərən nöqtələr müəyyən bir bölgədə daha sıxdır). .
Kosmosda elektronun tapılma ehtimalı yüksək olan bir bölgə var. Aydınlıq üçün orbital, elektronun görünmə ehtimalının ən böyük olduğu, başqa sözlə, elektron sıxlığının maksimum olduğu fəza bölgəsini təsvir edən səthlə məhdudlaşır (şək. 2b). Beləliklə, orbital elektronun 95% ehtimalı ilə yerləşdiyi bir növ həcmli cisim kimi qəbul edilməlidir.
Hidrogen atomunun elektron orbitalının sferik (sferik) forması var, buna görə də üçölçülü koordinatların hər oxu istiqamətində elektron sıxlığı eynidir (şək. 3). Bu sözdə s-orbital.
Bu günə qədər beş növ orbital təsvir edilmişdir: s, səh, d, f Və g.İlk üçünün adı tarixən formalaşıb, sonra əlifba prinsipi seçilib, ona görə də bu hərflər heç bir gizli məna daşımır. Orbitallar elektronların (işğal olunmuş orbitalların) və ya olmamasından (boş orbitalların) olmasından asılı olmayaraq mövcuddur. Maraqlıdır ki, hidrogenlə başlayan və bu gün əldə edilən sonuncu elementlə bitən hər bir elementin atomu bütün enerji səviyyələrində bütün orbitalların tam dəstinə malikdir və onların elektronlarla doldurulması elementin atom nömrəsi artdıqca baş verir, yəni. bir atomun nüvəsinin yükü.
Hər kimyəvi elementin atomu var s-hər enerji səviyyəsində bir belə orbital orbitallar. Onların hamısı sferik formadadır, lakin Təbiətin sürpriz hazırladığı yer budur. Əgər birinci enerji səviyyəsindədirsə s-orbital bərk cisimdir, sonra ikincidə kürə daxilində kürədir, üçüncüdə isə biri digərinin içərisində yuvalanmış üç kürə var (şək. 4).
Beləliklə, enerji səviyyəsinin nömrəsi ilə kodlanır s-daxili təbəqələrin sayından istifadə edən orbitallar (gizli barkodu xatırladır). Çoxqatlı strukturun fiziki mənası nədir? Fakt budur ki, sferik təbəqələr arasındakı boşluqlarda elektronlar olduqca nadir hallarda görünür, başqa sözlə, bu boşluqlarda elektron sıxlığı son dərəcə aşağıdır. Əvvəllər deyilirdi ki, orbital kosmosda elektron sıxlığının maksimum olduğu bölgədən istifadə etməklə təsvir olunur, ona görə də sıxlığı az olan yerlər boşluqdur.
Yeri gəlmişkən, üçüncü enerji səviyyəsi dövri sistemin üçüncü dövrünün elementlərində (ikinci səviyyə - ikinci dövr elementlərində, dördüncü səviyyə - dördüncü dövrün elementlərində və s.) doldurulmağa başlayır. ). Beləliklə, Təbiət eyni məlumatı iki dəfə şifrələdi - dövrlərin sayında və təbəqələrin sayında s-orbitallar.
Bundan başqa s- orbitallar da mövcuddur R-orbitallar. Üç belə orbital əvvəlcə ikinci enerji səviyyəsində görünür. Hər bir sonrakı səviyyədə də həmişə onlardan üçü olur. Nə çağırdılarsa R-orbitallar - həm ikiqanadlı pervaneli, həm də dumbbelllərlə; İndi "həcmli səkkizlər" adı müəyyən edilmişdir. Hər üç orbital zahiri cəhətdən eynidir, lakin kosmosda fərqli yönümlüdür. Onların maksimum elektron sıxlığı üç koordinat oxundan biri boyunca cəmlənir - X, y və ya z(şək. 5). Elektronun yerləşdiyi zaman onun ən çox ehtimal olunan yerləşdiyi bölgə məhz belə görünür R-orbitallar.
Bu orbitallar bütün dərsliklərdə belə təsvir edilmişdir. Maraqlıdır ki, bu orbitalların həqiqi forması (şəkil 6) ümumi qəbul ediləndən kəskin şəkildə fərqlənir (bax. Şəkil 5).
Onlar ümumiyyətlə uzanmış damcılara bənzəmirlər, əksinə çöreklərə və ya düymələrə bənzəyirlər. Məhz bu orbitallarda elektronlar dövri cədvəlin ikinci dövrünün elementlərində bordan başlayıb neonla bitir. Bu elementlərin adlandırılması tamamilə məntiqlidir R-elementlər. Adətən D.I.Mendeleyev cədvəlində R-elementlər xüsusi rənglə vurğulanır. Üçüncü enerji səviyyəsində də var R-orbitallardır, lakin onlar "ikinci mərtəbədə" yaşayan "qohumlarından" bir qədər fərqlidirlər (şək. 7). U 3 R-orbitallar "yubka" görünür, bütün dizayn antik stol lampasına bənzəyir, yalnız ikiqat görünür. Bu orbitallar alüminiumdan arqona qədər tədricən elektronlarla doldurulur, onlara da deyilir R-elementlər. Dövri cədvəldə onlar eyni rəngə malikdirlər R-ikinci dövrün elementləri.
Dördüncü enerji səviyyəsinə keçərkən "yubka" daha mürəkkəbləşir, indi bunlar tipik şampinonlardır (Şəkil 8), lakin inkişaf etmiş bir təxəyyülü olan bəzi elm adamları onları meduza adlandırırlar.
Beləliklə, hər bir növbəti səviyyəyə keçərkən təkcə görünüş dəyişmir s-çoxqat strukturu əldə edən orbitallar, həm də R-daralmış hissənin mürəkkəbləşdiyi orbitallar. Elm adamları bu cür qeyri-adi formaları necə görüb təsvir edə bildilər? Bu, kvant kimyası üsulları ilə aparılan hesablamaların nəticəsidir. Hesablamaların reallığa uyğunluğu struktur tədqiqatlarla təsdiqlənir.
Niyə bu qədər təhrif olunublar? R-kitablarda təsvir olunan orbitallar? Burada heç bir pis niyyət yoxdur, sadələşdirmənin nəticəsidir. Baş verən qarşılıqlı təsirləri izah etmək üçün orbitalların məkan yerini və onların təxmini konturlarını göstərmək kifayətdir. Bundan əlavə, damla formalı formanı təsvir etmək daha asandır və onun köməyi ilə kimyəvi bağların formalaşması zamanı baş verən orbitalların üst-üstə düşməsini çatdırmaq daha rahatdır. Özümüzə daha yaxın bir nümunə götürək. Reaksiya tənliyini yazarkən kimyəvi element simvollarından istifadə edərək atomları təmsil edirik. Eyni zamanda, biz onların hər birinin yanında olan bütün elektronları təsvir etmirik və elektronlardan hansının olduğunu göstərmirik. R, Onda hansı - s. Əksər hallarda bu tələb olunmur. Əgər belə bir ehtiyac yaranarsa, o zaman, məsələn, kovalent əlaqəni həyata keçirmək üçün reaksiya sxeminə bir cüt elektron daxil edilir.
Bununla belə, orbitalların həqiqi formaları vacibdir və orbitalların məkan qarşılıqlı təsirini nəzərə alan mürəkkəb hesablamalarda nəzərə alınır.
Bu çətin işi yalnız nadir həvəskarlar götürür. Onların səyləri sayəsində biz hər şeyin həqiqətən necə göründüyünü görə bilərik və eyni zamanda Təbiətin qəribə fantaziyasını qiymətləndirə bilərik.
Hər kəs öz orbitlərinə üstünlük verir
Əgər forma R-orbitallar ən çox üzvi kimya dərsliklərində, sonra aşağıdakılardan bəhs edilir d-orbitallar kompleks birləşmələrin xassələrini araşdıran koordinasiya kimyasında sevimli mövzudur. Bu orbitallar üçüncü enerji səviyyəsində görünür. Bu və hər sonrakı səviyyədə həmişə onlardan beşi var. d-Orbitallar dördüncü dövrün elementlərinin elektronları ilə doldurulmağa başlayır, sözdə keçid elementləri (daha tez-tez deyilir).
d-elementlər), skandiyumdan başlayaraq sinklə bitən. Dövri cədvəldə d-elementlər fərqli bir rəngə boyanır s- Və R-elementlər. forma d-orbitallar orbitallardan bir qədər mürəkkəbdir R-orbitallar. dörd d-orbitallar eyni görünüşə malikdir (dörd qanadlı pervane, daha dəqiq desək, dörd damcı çarpaz düzülmüşdür), lakin kosmosda fərqli istiqamətləndirilir. Beşinci d-orbitalın qeyri-adi forması var - üçölçülü səkkiz fiqur bir torusdan keçir, və ya gündəlik həyatda deyildiyi kimi, pişi. Adətən koordinasiya kimyası kitablarında bu orbitallar Şəkil 1-də göstərildiyi kimi təsvir olunur. 9.
Hamısı d-orbitallar hansı səviyyəyə aid olmasından asılı olmayaraq adətən bu şəkildə təsvir edilir. Ən maraqlısı Şəkildə göstərilmişdir. 9-da təsvirin əslindən demək olar ki, heç bir fərqi yoxdur, lakin bu, yalnız üçüncü səviyyəli orbitallara aiddir (şək. 10).
Beşinci dövrdə doldurulma baş verir d-dördüncü enerji səviyyəsinin orbitalları, nəticədə yeniləri meydana çıxır d-ittriumdan kadmiuma qədər elementlər cədvəldə tam olaraq eyni rəngdədir d-əvvəlki dövrün elementləri. Bütün əvvəlki hekayə bizi 4-cü görünüşə hazırladı d-orbitallar 3-dən bir qədər fərqli olacaq d-orbitallar. Bu, əslində belədir (şək. 11). Damcı formalı forma yerini göbələk formasına verir və əlavə ayaqlar kimi bir şey görünür. Oxşar üçün 5 d-orbitallar elektronları yerləşdirməyə başlayır d-altıncı dövrün elementləri, yəni lantanda və daha sonra hafniumdan civəyə qədər.
İndi bu, artıq təəccüblü görünmür d-beşinci enerji səviyyəsinin orbitalları daha mürəkkəb formaya malikdir (şək. 12).
Yalnız onların sadələşdirilmiş təsviri və formanın sırf keyfiyyətcə müzakirəsi tələb olunursa, şərti olaraq güman edə bilərik ki, bütün d-orbitallar şəkildə göstərilən formaya malikdir. 10. Şeffild Universitetinin alimi Mark Vinterin səyləri sayəsində hər şeyin həqiqətən necə göründüyünü görmək üçün xoş fürsətimiz var.
Hamı görmədi
Dördüncü enerji səviyyəsində yeddi görünür f- orbitallar və hər bir sonrakı səviyyədə həmişə onlardan yeddisi var. Onlar lantanidlər adlanan elementlərin elektronları ilə məskunlaşmağa başlayırlar (həmçinin f-elementlər), seriumdan başlayıb lutetiumla bitən. Onların dövri cədvəldəki hüceyrələri də xüsusi rəngə boyanmışdır. Əgər əvvəllər qeyd olunan bütün orbitalları müxtəlif kitablarda bu və ya digər formada görmək olarsa, onda görünüş f- Orbitallarla az adam tanışdır. Bu vaxt, sırf xarici olaraq, onlar yalnız kitabın səhifələrində görünməyə deyil, həm də örtüyü bəzəməyə layiqdirlər, lakin özünüz üçün mühakimə edin (Şəkil 13).
Dövri cədvəlin sonrakı dövründə təbii olaraq yeniləri meydana çıxır. f-toriumdan lorensiuma qədər elementlər formaya malikdir f- orbitallar daha da qeyri-adidir, iki böyük tori (donuts) arasında azaldılmış halqa görünür (şəkil 14).
Görünür ki, Təbiətin məkan təxəyyülü tükənməlidir, lakin sonra bizi daha mürəkkəb dizaynlar gözləyir.
Təbiətin son fantaziyası
Arxada f- orbitallar doqquzu izləyir g- orbitallar. Onlar növbəti (beşinci) enerji səviyyəsində, yəni müəyyən edilmiş qaydada tam uyğun olaraq görünür - hər yeni səviyyə özü ilə yeni növ orbitalları daşıyır. Əvvəllər deyilirdi ki, hər bir atom hidrogendən başlayaraq bütün orbitalların tam dəstinə malikdir. Bununla belə, elektronun müəyyən bir yuxarı orbitalda yerləşməsi üçün bütün əvvəlki orbitallar doldurulmalıdır (ətraflı məlumat üçün bax: Chemistry, 2000, No. 22. Chemical elements. Nailiyyətlər və perspektivlər). Üzərində elektron olan elementlərin adını hələ deyə bilmərik g- orbitallar, belə elementlər hələ əldə edilməmişdir. Hesablamalar göstərdi ki, bu orbitalda ilk dəfə 125 nömrəli kimyəvi element yerləşdirilə bilər. Bununla belə, çox güman ki, 118 nömrəli element bu gün seriya ilə başlayacaq № 125 g- elementlər (hər bir sonrakı bir elektron əlavə edəcək g- orbitallar), bu elementlər bütün əvvəlki dövri cədvəldə analoqları yoxdur; Onları əldə etmək o qədər də asan deyil, lakin onların xassələrini öyrənmək daha çətin olacaq, çünki onlar çox güman ki, qısamüddətli radioaktiv elementlər olacaqlar. Onların qəbul edildiyi anı gözləmədən, artıq görünüşünə heyran ola bilərik g- orbitallar (şək. 15).
Təsəvvür etmək belə çətindir ki, Təbiət elektronları ən çox ehtimal olunan yerlərin belə qəribə sahələri ilə təmin edib. Bu orbitalları müqayisə etmək üçün real təsvirləri tapmaq asan deyil. Noxud və qəhvə dənələrinin çoxluqlarına bənzəyən səkkiz qeyri-adi konqlomerat və bunların hamısının üstündə iki damla formalı gövdə ilə deşilmiş müxtəlif ölçülü beş toridən yığılmış kosmik gəmi dayanır. Bütün bu doqquz orbital anlaşılmaz şəkildə bir atom nüvəsinin ətrafında bir-birinə müdaxilə etmədən yerləşdirilmişdir. Bizim təxəyyülümüz belə bir şeyi təsəvvür edə bilmir, çünki burada başqa qaydalar tətbiq olunur - kvant mexanikasının qanunları. Təbii ki, bizim təxəyyülümüz belə reallıqla rəqabətdə uduzur.
Dəqiq deyil, amma başa düşüləndir
Şəklin sağ tərəfində göstərilən CH 4 metan molekuluna yenidən qayıdaq. 1. Karbon atomu, bütün sonrakı elementlər kimi, ikinci enerji səviyyəsində dörd orbitala malikdir (bir s və üç R). Bundan əlavə, karbonun dörd valent elektronu var, onlardan ikisi üzərində yerləşir s-orbitallar və ikidə bir elektron daha R-orbitallar (şəkil 16, sol alt), üçüncü R-karbon orbitalı tutulmamışdır.
Bir karbon atomunun dörd hidrogen atomu ilə dörd kimyəvi bağ əmələ gətirdiyi anda, dörd orbitalın hamısı birləşərək, hibrid orbitalları əmələ gətirir (şək. 16, yuxarı sağ), onlar asimmetrik üçölçülü səkkiz rəqəmi (böyük bir damla və kiçik quyruq). Hibrid orbitalların nədən hazırlandığını göstərmək üçün adətən yazırlar -
sp 3-orbitallar, yəni birindən əldə edilir s- və üç R-orbitallar (hibridlərin əmələ gəlməsində nə qədər orbital iştirak edir, eyni sayda hibrid orbital alınır).
Bu cür şəkilləri bütün üzvi kimya dərsliklərində görmək olar və hibridlərin əsl görünüşü Şek. 17. Formalarını daha aydın göstərmək üçün hibrid orbitallar bir-birindən müəyyən məsafədə təsvir edilmişdir (şəkil 17, sol). Bütün mənzərəni reallıqda görmək üçün bu orbitallar kosmosda birləşdirilməlidir ki, dörd ağ nöqtə üst-üstə düşsün (karbon nüvəsi burada yerləşir). Nəticə Şəkildə göstərilmişdir. 17, sağ.
Bundan əlavə, xəyali tetraedrin təpələrinə doğru yönəlmiş bu dörd orbital dörd hidrogen atomunun sferik orbitalları ilə üst-üstə düşür, bu da dörd kimyəvi bağın yaranmasına uyğun gəlir (bax. Şəkil 1). Burada sırf qrafik çətinliklər yaranır - əgər siz dörd kürəni “bir-birinə yapışan” sferik həcmlərdən ibarət rəqəmə yaxınlaşdırsanız (bax. Şəkil 17, sağda), onda belə bir şəkildə heç nə görə bilməyəcəksiniz. Hibrid orbitallar qəsdən uzanarsa, hər şey daha aydın görünür (bax. Şəkil 16). Beləliklə, orbitalların həqiqi forması aydınlıq naminə daim təhrif edilir və burada heç bir şeyə etiraz etmək çətindir, lakin Şeklin dəqiqliyini sevənlər üçün. 17 hər şeyin həqiqətən necə göründüyünü zehni olaraq təsəvvür etməyə kömək edəcək.
Orbitallar - yaradıcılıq mənbəyidir
Kimyaçılar adətən öz mülahizələrində irəli getmirlərsə d-orbitallar, f- Və g- orbitallarla daha az maraqlanırlar, sonra digər peşə sahibləri ilk növbədə qeyri-adi memarlıq cəlbediciliyinə görə son iki qrupa tez diqqət yetirdilər. Tətbiqi sənətkarlar, dizaynerlər, konstruktorlar və dekorativlər yaradıcı fantastikanı üstələyən çox qeyri-standart motivlər təklif edən Təbiətin təxəyyülünü yüksək qiymətləndirdilər. Zərgərlik sənətinin ustaları bu cür əşyaları onların əsasında müasir zərgərlik yaratmaq üçün çox maraqlı hesab edirdilər (şək. 18).
Mebel, ayaqqabı, məişət texnikası nümunələri yaradan rəssamlar bu məşhur görüntüləri nəzərdən qaçıra bilməyiblər. İndi orbitləri şəhər emblemlərində də görmək olar, d-orbitallar pasifist emblemlərindən birində nümayiş etdirilir və R-orbitallar uzun müddət qum eynəyi istehsalında nümunə kimi xidmət etmişdir (şək. 19).
Orbital dizayn memarlıqda xüsusilə yaxşı görünür, burada körpü dayaqlarını və televiziya qüllələrini bəzəyir. Yeri gəlmişkən, formalar g- orbitallar heyrətləndirici şəkildə rele antenalarının ideal parametrlərinə uyğun gəlir (şək. 20).
Orbital dizayn adlanan bu bütöv bədii hərəkət əlavə olaraq yeni terminin cazibədar səsi ilə alıcıları və müştəriləri cəlb edir.
Ciddi nədir və gülümsəmək nədir?
Göstərilən bütün orbitalların görünüşü, bir qədər fantastik olmasına baxmayaraq, dəqiq hesablamaların nəticəsidir və tamamilə doğrudur. Oxuculara “orbital dizayn” ümumi adı ilə bədii yaradıcılıq tendensiyası nə qədər ciddi olduğuna özləri qərar vermək imkanı veririk. Kimyada birlikdə təqdim olunan ciddi və yumoristik mövzuların birləşməsini tapmaq olduqca yaygındır. Əvvəlki illərdə “Ximiya” qəzetinin aprel saylarında bu qəbildən olan müxtəlif materiallar müntəzəm dərc olunurdu. Bu nəşrlərdən öyrənmək olar: dövri cədvəldən istifadə edərək taleyi necə proqnozlaşdırmaq olar, əczaçılar, qurmanlar və müxtəlif içkiləri sevənlər üçün hansı dövri cədvəllər mövcuddur, dərmanların qəbulu prosedurunu son dərəcə xoş etmək üçün polimer kimyasından istifadə etmək mümkündürmü, necə etmək olar. kimyada məşhur olmaq, kimyaçılar arasında canlı ünsiyyətin xüsusiyyətləri və daha çox.